题目内容
在高温下,下列反应达到平衡:C(s)+H2O(g)═CO(g)+H2(g)(正反应为吸热反应).如果升高温度,平衡向 移动;如果增大压强,平衡向 移动,如果增大水蒸气的浓度,平衡向 移动.
考点:化学平衡的影响因素
专题:化学平衡专题
分析:化学反应的特征是反应前后气体体积增大的吸热反应,依据化学平衡移动原理分析判断;
解答:
解:在高温下,下列反应达到平衡:C(s)+H2O(g)═CO(g)+H2(g)(正反应为吸热反应).如果升高温度,平衡先吸热反应方向进行,所以平衡正向进行;增大压强平衡向气体体积减小的方向进行,平衡逆向进行;增大水蒸气浓度,增大反应物浓度平衡正向进行;
故答案为:正反应方向,逆反应方向,正反应方向.
故答案为:正反应方向,逆反应方向,正反应方向.
点评:本题考查了化学平衡影响因素的分析判断,化学平衡移动原理是解题关键,题目较简单.

练习册系列答案
相关题目
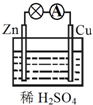 关于如图所示的原电池,下列说法不正确的是( )
关于如图所示的原电池,下列说法不正确的是( )| A、Cu为正极,Zn为负极 |
| B、该装置能将化学能转化为电能 |
| C、电子由铜片通过导线流向锌片 |
| D、正极反应为 2H++2e-═H2↑ |
 如图是某有机物分子球棍模型,其中白球表示氢原子,黑球表示碳原子,短棍表示共价键.对该物质的说法正确的是( )
如图是某有机物分子球棍模型,其中白球表示氢原子,黑球表示碳原子,短棍表示共价键.对该物质的说法正确的是( )| A、名称为乙烷 |
| B、不能燃烧 |
| C、一种饱和烃 |
| D、化学式为C2H4 |
 在一定条件下进行化学反应,请根据以下的转化关系回答下列问题,
在一定条件下进行化学反应,请根据以下的转化关系回答下列问题,