题目内容
19.NA表示阿伏加德罗常数的值,下列有关说法正确的是( )| A. | 常温常压下,16g14CH4所含中子数目为8NA | |
| B. | 标准状况下,7.8g苯中含碳碳双键的数目为0.3NA | |
| C. | 含0.2NA个阴离子的Na2O2和水完全反应转移0.2mol电子 | |
| D. | 5.6g铁粉在足量的氯气中充分燃烧,得到电子数为0.3NA |
分析 A、14CH4的摩尔质量为18g/mol,结构中含8个中子;
B、苯不是单双键交替的结构;
C、过氧化钠由2个钠离子和1个过氧根构成;
D、求出铁的物质的量,然后根据铁在氯气中燃烧后变为+3价来分析.
解答 解:A、14CH4的摩尔质量为18g/mol,故16g甲烷的物质的量小于1mol,而此甲烷的结构中含8个中子,故其含有的中子数小于8NA个,故A错误;
B、苯不是单双键交替的结构,故苯中无碳碳双键,故B错误;
C、过氧化钠由2个钠离子和1个过氧根构成,故含0.2NA个阴离子的过氧化钠的物质的量为0.2mol,而过氧化钠和水反应时,1mol过氧化钠转移1mol电子,故0.2mol过氧化钠转移0.2NA个电子,故C正确;
D、5.6g铁的物质的量为0.1mol,而铁在氯气中燃烧后变为+3价,故铁在反应时是失0.3NA个电子而非得电子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
14.下列离子可以在溶液中大量共存的是( )
| A. | Na+、Ag+、NO3-、Cl- | B. | K+、Ba2+、Cl-、CO32- | ||
| C. | Na+、Fe3+、NO3-、SO42- | D. | Na+、Mg2+、OH-、NO3- |
4.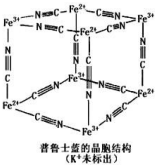 普鲁士蓝晶体结构如图所示(每两个立方体中,一个 K+在其中一个立方体中心,另一个则无 K+),下列说法正确的是( )
普鲁士蓝晶体结构如图所示(每两个立方体中,一个 K+在其中一个立方体中心,另一个则无 K+),下列说法正确的是( )
 普鲁士蓝晶体结构如图所示(每两个立方体中,一个 K+在其中一个立方体中心,另一个则无 K+),下列说法正确的是( )
普鲁士蓝晶体结构如图所示(每两个立方体中,一个 K+在其中一个立方体中心,另一个则无 K+),下列说法正确的是( )| A. | 化学式可以表示为 KFe2(CN)6 | |
| B. | 每一个立方体中平均含有 24 个π键 | |
| C. | 普鲁士蓝不属于配位化合物 | |
| D. | 每个 Fe3+周围与之相邻的 Fe2+离子有 12 个 |
8.下列说法正确的是( )
| A. | 纯碱、汽油去除油污的原理相同 | |
| B. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 | |
| C. | 铁表面镀铜时,铜与电源的正极相连,铁与电源的负极相连 | |
| D. | 分馏、蒸馏、煤的液化都是物理变化,干馏、裂化、裂解都是化学变化 |
9.常温下能与水反应的非金属单质是( )
| A. | Na | B. | C | C. | Cl2 | D. | NH3 |
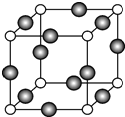 已知A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期元素且最外层只有2对成对电子,F元素与Cr元素位于同一周期的副族元素中且基态原子的最外层电子数与Cr原子相同.
已知A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期元素且最外层只有2对成对电子,F元素与Cr元素位于同一周期的副族元素中且基态原子的最外层电子数与Cr原子相同.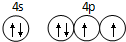 .
.
