题目内容
下列有关硫及其化合物的性质的说法中,正确的是( )
| A、铜粉和硫粉混合加热可制得CuS |
| B、久置酸雨酸性增强,原因是水的挥发 |
| C、加热经SO2漂白的品红试液,颜色不变 |
| D、SO2通人含有大量H+的KMnO4溶液中,溶液褪色,体现了SO2的还原性 |
考点:含硫物质的性质及综合应用
专题:
分析:A、硫单质氧化性弱氧化变价金属生成低价化合物;
B、酸雨酸性增强是二氧化硫和水反应生成的亚硫酸被空气中的氧气氧化得到硫酸溶液;
C、二氧化硫漂白性不稳定,加热恢复原来的颜色;
D、二氧化硫具有还原性,易被酸性高锰酸钾溶液氧化;
B、酸雨酸性增强是二氧化硫和水反应生成的亚硫酸被空气中的氧气氧化得到硫酸溶液;
C、二氧化硫漂白性不稳定,加热恢复原来的颜色;
D、二氧化硫具有还原性,易被酸性高锰酸钾溶液氧化;
解答:
解:A、硫单质氧化性弱氧化变价金属生成低价化合物,铜粉和硫粉混合加热可制得Cu2S,故A错误;
B、酸雨酸性增强是二氧化硫和水反应生成的亚硫酸被空气中的氧气氧化得到硫酸溶液,久置酸雨酸性增强,故B错误;
C、二氧化硫漂白性不稳定,加热恢复原来的颜色,加热经SO2漂白的品红试液,颜色恢复红色,故C错误;
D、二氧化硫具有还原性,易被酸性高锰酸钾溶液氧化,溶液褪色,体现了SO2的还原性,故D正确;
故选D.
B、酸雨酸性增强是二氧化硫和水反应生成的亚硫酸被空气中的氧气氧化得到硫酸溶液,久置酸雨酸性增强,故B错误;
C、二氧化硫漂白性不稳定,加热恢复原来的颜色,加热经SO2漂白的品红试液,颜色恢复红色,故C错误;
D、二氧化硫具有还原性,易被酸性高锰酸钾溶液氧化,溶液褪色,体现了SO2的还原性,故D正确;
故选D.
点评:本题考查了硫及其化合物性质的分析判断,二氧化硫的漂白性、还原性,酸雨形成原因,注意硫单质和变价金属反应生成低价化合物,题目较简单.

练习册系列答案
相关题目
下列有关物质的性质或实验正确的是( )
| A、能使湿润的淀粉碘化钾试纸变蓝的气体为NO2 |
| B、能使品红溶液褪色的气体为SO2 |
| C、将过量过氧化钠加入酚酞试液中,有气体产生,溶液先变红后褪色 |
| D、向某溶液中依次加入溴水、硫氰化钾溶液,溶液变为血红色,则原溶液中含有Fe2+ |
对于反应aX(g)+bY(g)?cZ(g)+dR(g)△H=QkJ/mol反应开始时,容器内充入X、Y或Z、R,如图所示表示反应达到平衡后,图1、图2分别表示反应达到平衡后,改变温度和压强对反应的影响,下列叙述中正确的是( )


| A、开始时充入X和Y a+b>c+d Q<0 |
| B、开始时充入X和Y a+b>c+d Q>0 |
| C、开始时充入Z和R a+b>c+d Q<0 |
| D、开始时充入Z和R a+b<c+d Q>0 |
下列反应的离子方程式书写正确的是( )
| A、澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
| B、四氧化三铁溶于稀硝酸:Fe3O4+8H+=4H2O+Fe2++2Fe3+ |
| C、二氧化硅与烧碱溶液反应:SiO2+2OH-═SiO32-+H2O |
| D、硅酸与烧碱溶液中和:H2SiO3+2OH-═SiO32-+2H2O |

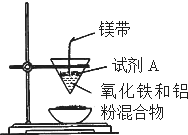 某小组进行铝热反应实验,装置如图所示.
某小组进行铝热反应实验,装置如图所示.