题目内容
已知A、B、C、D四种元素的原子序数分别为8、13、17、25,回答下列问题:
(1)写出元素符号:A. B. C. D.
(2)A的原子结构示意图为 ,C的价层电子构型为 .
(3)由B、C两种元素形成的一种物质属于化合物 (填“共价”或“离子“).
(4)A、B、C、D四种元素中未成对电子数最多是个 (填数值).
(1)写出元素符号:A.
(2)A的原子结构示意图为
(3)由B、C两种元素形成的一种物质属于化合物
(4)A、B、C、D四种元素中未成对电子数最多是个
考点:原子结构与元素的性质,化学键
专题:原子组成与结构专题
分析:(1)A、B、C、D分别为元素:O;Al;Cl;Mn;
(2)氧为8号元素,Cl为第三周期第ⅤⅡA族元素;
(3)氯化铝是共价化合物;
(4)根据核外电子排布规律写出各原子的最外层电子排布,结合轨道排布式解答.
排布规律:1、泡利不相容原理:每个轨道最多只能容纳两个电子,且自旋相反配对;
2、能量最低原理:电子尽可能占据能量最低的轨道;
3、洪特规则:简并轨道(能级相同的轨道)只有被电子逐一自旋平行地占据后,才能容纳第二个电子.
(2)氧为8号元素,Cl为第三周期第ⅤⅡA族元素;
(3)氯化铝是共价化合物;
(4)根据核外电子排布规律写出各原子的最外层电子排布,结合轨道排布式解答.
排布规律:1、泡利不相容原理:每个轨道最多只能容纳两个电子,且自旋相反配对;
2、能量最低原理:电子尽可能占据能量最低的轨道;
3、洪特规则:简并轨道(能级相同的轨道)只有被电子逐一自旋平行地占据后,才能容纳第二个电子.
解答:
解:(1)A、B、C、D四种元素的原子序数分别为8、13、17、25,分别为元素:O;Al;Cl;Mn,故答案为:O;Al;Cl;Mn;
(2)氧原子的结构示意图为 ,Cl为第三周期第ⅤⅡA族元素,则价电子构型为3s23p5,故答案为:
,Cl为第三周期第ⅤⅡA族元素,则价电子构型为3s23p5,故答案为: ;3s23p5;
;3s23p5;
(3)B、C两种元素为Al;Cl,氯化铝是共价化合物,故答案为:共价;
(4)O的电子排布式为1s22s22p4,未成对电子数为2;
Al的电子排布式为1s22s22p63s23p1,未成对电子数为1;
Cl原子的价层电子排布式为2s22p5,p能级有3个简并轨道,5个电子占据3个轨道,其中2个轨道填充满2个电子,另外1个轨道填充1个电子,有1个未成对电子;
Mn的电子排布式为1s22s22p63s23p63d54s2,未成对电子数为5;
故答案为:5.
(2)氧原子的结构示意图为
 ,Cl为第三周期第ⅤⅡA族元素,则价电子构型为3s23p5,故答案为:
,Cl为第三周期第ⅤⅡA族元素,则价电子构型为3s23p5,故答案为: ;3s23p5;
;3s23p5;(3)B、C两种元素为Al;Cl,氯化铝是共价化合物,故答案为:共价;
(4)O的电子排布式为1s22s22p4,未成对电子数为2;
Al的电子排布式为1s22s22p63s23p1,未成对电子数为1;
Cl原子的价层电子排布式为2s22p5,p能级有3个简并轨道,5个电子占据3个轨道,其中2个轨道填充满2个电子,另外1个轨道填充1个电子,有1个未成对电子;
Mn的电子排布式为1s22s22p63s23p63d54s2,未成对电子数为5;
故答案为:5.
点评:本题考查原子结构与元素的性质,难度不大,比较基础,注意理解核外电子排布规律.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
联苯的结构简式: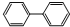 ,下列有关联苯的说法中正确的是( )
,下列有关联苯的说法中正确的是( )
 ,下列有关联苯的说法中正确的是( )
,下列有关联苯的说法中正确的是( )| A、分子中含有6个碳碳双键 |
| B、联苯的一硝基取代产物的3种 |
| C、它容易发生加成反应、取代反应,容易被强氧化剂氧化 |
D、它和蒽(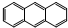 )同属于芳香烃,两者互为同系物 )同属于芳香烃,两者互为同系物 |
下列反应中属于加成反应的是( )
| A、乙烷与氯气在光照条件下的反应 |
| B、乙烯使酸性高锰酸钾溶液褪色 |
| C、己烷与溴水混合振荡,静置后溴水层褪色 |
| D、在催化剂作用下,乙烯和水反应生成乙醇 |
A、B、C三种物质的化学式相同,但结构不同,它们之间的转化如下所示:1molA
1molB
1molC,已知:a>b,下列说法正确的是( )
| 吸收akJ能量 |
| 放出bkJ能量 |
| A、A-C是放热反应 |
| B、A-C的△H的大小与A、B、C的聚集状态无关 |
| C、A-B一定没有化学键的断裂 |
| D、物质A比物质C更稳定 |
短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为10,A和C同主族,B原子的最外层电子数等于A原子的次外层电子数,下列叙述中正确的是( )
| A、原子半径:A<B<C |
| B、C的最简单氢化物的稳定性大于A的最简单氢化物的稳定性 |
| C、高温下,A单质能置换出C单质 |
| D、三种元素的最高价氧化物对应的水化物均可由化合反应得到 |
下列叙述正确的是( )
| A、氯化钠溶液在电流作用下电离成Na+与Cl? |
| B、溶于水后能电离出H+的化合物都是酸 |
| C、氯化氢溶于水后能导电,但液态氯化氢不能导电 |
| D、导电性强的溶液中自由移动离子数目一定比导电性弱的溶液中自由移动离子数目多 |
近年用红外激光技术研究液氢,发现液氢中含有H3+.则H3+应该属于( )
| A、单质 | B、分子 | C、原子 | D、离子 |