题目内容
1.对一份稀溶液作初步分析后发现,溶液无色、澄清可能含有SO42-、Na+、CO32-、H+、NO3-、HCO3-、Cl-等离子中的若干种.然后又作了如下分析,以确定这些离子是否大量存在.①用PH试纸测溶液PH,测得溶液PH=1;
②取2mL溶液用BaCl2溶液和稀HNO3进行检验,结果生成了白色沉淀;
③对②中所得的混合物充分静置后,取其上层澄清的液体用AgNO3溶液和稀硝酸进行检验,结果又生成了白色沉淀.
根据以上现象,请回答下列问题:
(1)原溶液中一定存在的离子是H+、SO42-;
(2)一定不存在的离子是CO32-、HCO3-,写出你判断的依据(用离子方程式表示):H++HCO3-=CO2↑+H2O、2H++CO32-=CO2↑+H2O
(3)在上述实验操作中,有错误的步骤是(填写代号)②,对该错误改正的方法是(要作较详细的说明)硝酸钡代替氯化钡.
分析 给出的离子均为无色,由①用PH试纸测溶液PH,测得溶液PH=1,则溶液显酸性,一定不含CO32-、HCO3-,一定含H+;
②取2mL溶液用BaCl2溶液和稀HNO3进行检验,结果生成了白色沉淀,白色沉淀为BaSO4,则一定含SO42-;
③对②中所得的混合物充分静置后,取其上层澄清的液体用AgNO3溶液和稀硝酸进行检验,结果又生成了白色沉淀,则白色沉淀为AgCl,因②中引入Cl-,不能确定原溶液是否含Cl-,以此来解答.
解答 解:给出的离子均为无色,由①用PH试纸测溶液PH,测得溶液PH=1,则溶液显酸性,一定不含CO32-、HCO3-,一定含H+;
②取2mL溶液用BaCl2溶液和稀HNO3进行检验,结果生成了白色沉淀,白色沉淀为BaSO4,则一定含SO42-;
③对②中所得的混合物充分静置后,取其上层澄清的液体用AgNO3溶液和稀硝酸进行检验,结果又生成了白色沉淀,则白色沉淀为AgCl,因②中引入Cl-,不能确定原溶液是否含Cl-,
(1)原溶液中一定存在的离子是H+、SO42-,故答案为:H+、SO42-;
(2)由上述分析一定没有CO32-、HCO3-离子,酸溶液中发生H++HCO3-=CO2↑+H2O、2H++CO32-=CO2↑+H2O,
故答案为:CO32-、HCO3-;H++HCO3-=CO2↑+H2O、2H++CO32-=CO2↑+H2O;
(3)上述实验操作中,有错误的步骤是②,取2毫升溶液,用氯化钡和稀硝酸进行检验,结果生成了白色沉淀,改用硝酸钡代替氯化钡,对后续实验(验证氯离子的存在与否)不会造成干扰,故答案为:②;硝酸钡代替氯化钡.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应及离子检验等为解答的关键,侧重分析与应用能力的能力,注意常见离子检验方法的应用,题目难度中等.

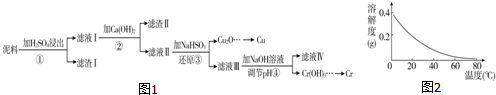
已知:部分物质沉淀的pH如表:
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
请回答下列问题:
(1)滤液Ⅰ中所含溶质主要有Fe2(SO4)3、Cr2(SO4)3、CuSO4(填化学式).
(2)第②步操作中,先加入Ca(OH)2调节溶液的pH,调节范围为3.2≤pH<4.3,然后将浊液加热至80℃趁热过滤,所得滤渣Ⅱ的成分为Fe(OH)3、CaSO4.
(3)第③步操作中,发现除了生成砖红色沉淀外,还产生了无色刺激性气味的气体.写出该步骤中发生反应的离子方程式2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+、HSO3-+H+=SO2↑+H2O.
(4)当离子浓度≤1×10-5 mol•L-1时,可以认为离子沉淀完全.第④步操作中,若要使Cr3+完全沉淀,则室温下溶液中a的最小值为5.6.已知:Ksp[Cr(OH)3]=6.3×10-31,$\root{3}{64}$≈4.0;lg 4=0.6.
(5)Cr(OH)3受热分解为Cr2O3,用铝热法可以冶炼金属铬.写出铝热法炼铬的化学方程式Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Cr.
| A. | a L | B. | $\frac{a}{2}$ L | C. | $\frac{a}{3}$ L | D. | 无法计算 |
| A. | 1 mol氢约含有阿伏伽德罗常数个氢 | |
| B. | 1 molCaCl2含有2 mol Cl- | |
| C. | 1 mol氢气含有6.02×1023个电子 | |
| D. | 1 molH2O含有1 molH2和1 molO |
| A. | 银氨溶液 | B. | 氢氧化铜固体 | C. | 石蕊试液 | D. | 碳酸钠溶液 |
| A. | 简单离子半径:E<D | |
| B. | 气态氢化物的稳定性:B<E | |
| C. | 最高价氧化物对应水化物的碱性:C>D | |
| D. | A与E形成的化合物为离子化合物 |
| A. | 除去MgCl2溶液中少量的FeCl3,可选用MgCO3 | |
| B. | 等物质的量浓度的(NH4)2SO4溶液和(NH4)2CO3溶液中NH4+的浓度前者大于后者 | |
| C. | NaHS溶液中,滴入少量CuCl2溶液,产生黑色沉淀,HS-的水解程度增大,pH增大 | |
| D. | 用饱和氯化铵溶液可以清洗金属表面的锈迹 |