题目内容
下列单质或化合物性质的描述正确的是( )
| A、NaHCO3的热稳定性大于Na2CO3 |
| B、SiO2与酸、碱均不反应 |
| C、常温下,NO易与空气中氧气发生化合反应 |
| D、氯化氢与氨气相遇,有大量的白雾生成 |
考点:钠的重要化合物,氨的化学性质,硅和二氧化硅
专题:
分析:A.NaHCO3加热易分解,热稳定性小于于Na2CO3;
B.氢氟酸能和二氧化硅反应,氢氧化钠能和二氧化硅反应;
C.常温下,NO易与空气中氧气发生化合反应生成二氧化氮;
D.氯化氢与氨气相遇生成固体氯化铵,所以有大量的白烟.
B.氢氟酸能和二氧化硅反应,氢氧化钠能和二氧化硅反应;
C.常温下,NO易与空气中氧气发生化合反应生成二氧化氮;
D.氯化氢与氨气相遇生成固体氯化铵,所以有大量的白烟.
解答:
解:A.NaHCO3加热易分解,热稳定性小于Na2CO3,故A错误;
B.氢氟酸能和二氧化硅发生SiO2+4HF═SiF4↑+2H2O,玻璃中含有二氧化硅,常用此反应在玻璃上刻字;氢氧化钠能和二氧化硅发生2NaOH+SiO2═Na2SiO3+H2O,实验室盛放氢氧化钠溶液的试剂瓶不能用玻璃塞,其原因是玻璃中的SiO2与NaOH反应,生成具有粘性的Na2SiO3,会粘住瓶塞,故B错误;
C.常温下,NO易与空气中氧气发生化合反应生成二氧化氮,故C正确;
D.氯化氢与氨气相遇生成固体氯化铵,所以有大量的白烟,不是白雾,故D错误;
故选C.
B.氢氟酸能和二氧化硅发生SiO2+4HF═SiF4↑+2H2O,玻璃中含有二氧化硅,常用此反应在玻璃上刻字;氢氧化钠能和二氧化硅发生2NaOH+SiO2═Na2SiO3+H2O,实验室盛放氢氧化钠溶液的试剂瓶不能用玻璃塞,其原因是玻璃中的SiO2与NaOH反应,生成具有粘性的Na2SiO3,会粘住瓶塞,故B错误;
C.常温下,NO易与空气中氧气发生化合反应生成二氧化氮,故C正确;
D.氯化氢与氨气相遇生成固体氯化铵,所以有大量的白烟,不是白雾,故D错误;
故选C.
点评:本题主要考查了元素化合物的知识,考查角度广,要求学生具有分析和解决问题的能力,平时注意相关知识的积累,题目难度中等.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
一定温度下,在0.1mol/L强电解质NaHB的溶液中,c(H+)>c(OH-),则下列判断中一定正确的是( )
| A、c(Na+)+c(H+)=2c(B2-)+c(OH-) |
| B、c(Na+)=0.1mol/L≥c(B2-) |
| C、c(H+)?c(OH-)=1.0×10-14 |
| D、溶液的pH=1.0 |
用0.1mol/L的NaOH溶液滴定100mL0.1mol/L盐酸时,如果滴定误差在±0.1%以内,反应完毕后,溶液的pH范围是( )
| A、6.9~7.1 |
| B、3.3~10.7 |
| C、4.3~9.7 |
| D、6~8 |
下列叙述正确的是( )
| A、Na2O是淡黄色固体,和水反应生成NaOH,是碱性氧化物 |
| B、在Na2O2与水的反应中,氧化剂是Na2O2,还原剂是水 |
| C、SO2通入品红中红色褪去,加热后红色恢复 |
| D、将Cl2与SO2按物质的量之比1:1通入紫色石蕊试液,溶液先变红后褪色 |
光导纤维的主要成分是( )
| A、纯硅 |
| B、玻璃 |
| C、纯SiO2 |
| D、硅酸盐 |
下列不属于电解质的是( )
| A、NaCl |
| B、H2O |
| C、Fe |
| D、HCl |
碘的熔点和沸点较低,其原因是( )
| A、碘的非金属性较弱 |
| B、碘分子(I2)中I---I键不稳定 |
| C、碘晶体属于分子晶体 |
| D、碘的氧化性较弱 |
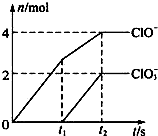 向一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-的反应为:6Ca(OH)2+6Cl2
向一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-的反应为:6Ca(OH)2+6Cl2