题目内容
某研究小组经查阅资料得知:2FeSO4
Fe2O3+SO3↑+SO2↑;FeSO4
FeO+SO3↑,SO3的熔点是16.8℃,沸点是44.8℃.
I.该小组探究在酒精喷灯加热条件下FeSO4分解的气体产物,实验装置如图所示.
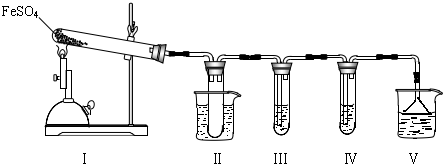
(1)装置Ⅱ的试管中不装任何试剂,其作用是 ,试管浸泡在50℃的水浴中,目的是 .
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验气体产物成分.请完成实验设计,填写检验试剂、预期现象与结论.
限选试剂:3mol?L-1 H2SO4溶液、6mol?L-1 NaOH溶液、0.5mol?L-1 BaCl2溶液、0.5mol?L-1 Ba(NO3)2溶液、0.01mol?L-1酸性KMnO4溶液、0.01mol?L-1溴水.
Ⅱ.FeSO4固体往往含有Fe2(SO4)3杂质,该研究小组采用称重法确定固体中铁元素的质量分数,操作流程为: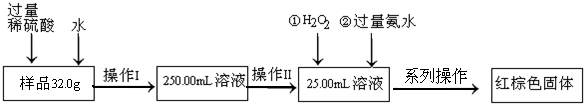
请根据流程回答:
(1)操作Ⅱ中必须用到的仪器是
A.25mL酸式滴定管 B.50mL 量筒 C.25mL 量筒 D.25mL碱式滴定管
(2)系列操作名称依次为 、 、 .
(3)若最终测得红棕色固体质量为3.2g,则样品中铁元素的质量分数为 .
| ||
| ||
I.该小组探究在酒精喷灯加热条件下FeSO4分解的气体产物,实验装置如图所示.

(1)装置Ⅱ的试管中不装任何试剂,其作用是
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验气体产物成分.请完成实验设计,填写检验试剂、预期现象与结论.
限选试剂:3mol?L-1 H2SO4溶液、6mol?L-1 NaOH溶液、0.5mol?L-1 BaCl2溶液、0.5mol?L-1 Ba(NO3)2溶液、0.01mol?L-1酸性KMnO4溶液、0.01mol?L-1溴水.
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中加入 | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置Ⅳ的试管中加入 |

请根据流程回答:
(1)操作Ⅱ中必须用到的仪器是
A.25mL酸式滴定管 B.50mL 量筒 C.25mL 量筒 D.25mL碱式滴定管
(2)系列操作名称依次为
(3)若最终测得红棕色固体质量为3.2g,则样品中铁元素的质量分数为
考点:性质实验方案的设计
专题:实验设计题
分析:I.(1)根据安全瓶的作用是可以防止倒吸;当温度高于44.8°C时SO3为气体状态;
(2)根据FeSO4分解的气体产物可能为SO3,也可能是SO3和SO2的混合物,SO3遇到钡离子生成白色沉淀,SO2能使高锰酸钾或溴水褪色;
Ⅱ.(1)量取精确度较高的酸性溶液用到酸式滴定管;
(2)从溶液中得到氢氧化铁沉淀,又到氧化铁,这条线索思考;
(3)据铁原子守恒解题.
(2)根据FeSO4分解的气体产物可能为SO3,也可能是SO3和SO2的混合物,SO3遇到钡离子生成白色沉淀,SO2能使高锰酸钾或溴水褪色;
Ⅱ.(1)量取精确度较高的酸性溶液用到酸式滴定管;
(2)从溶液中得到氢氧化铁沉淀,又到氧化铁,这条线索思考;
(3)据铁原子守恒解题.
解答:
解:I.(1)Ⅰ中产生的气体极易和溶液反应时,会产生倒吸,所以装置II的试管能防止溶液倒吸入装置Ⅰ中(或安全瓶);SO3的沸点是44.8°C,当温度高于44.8°C时SO3为气体状态,把试管浸泡在50℃的热水浴中能防止SO3液化或凝固,
故答案为:防止溶液倒吸入装置Ⅰ中(或安全瓶);防止SO3液化或凝固;
②FeSO4分解的气体产物可能为SO3,也可能为SO3和SO2的混合物,SO3遇到钡离子生成白色沉淀,SO2能使高锰酸钾或溴水褪色;
故答案为:
Ⅱ.(1)该溶液为酸性,精确度为0.01的仪器为酸式滴定管,所以选25mL酸式滴定管,
故答案为:A
(2)从溶液中得到氢氧化铁沉淀,要过滤、洗涤;从氢氧化铁到氧化铁,要灼烧,
故答案为:过滤、洗涤、灼烧
(3)Fe2O3中铁的质量为:
×3.2g=2.24g,据铁原子守恒,则32.0g样品中铁元素的质量分数为:
×
×100%=70%,
故答案为:70%
故答案为:防止溶液倒吸入装置Ⅰ中(或安全瓶);防止SO3液化或凝固;
②FeSO4分解的气体产物可能为SO3,也可能为SO3和SO2的混合物,SO3遇到钡离子生成白色沉淀,SO2能使高锰酸钾或溴水褪色;
故答案为:
| 0.5 mol.L -1 BaCl2 | |
| 0.01 mol.L-1 酸性 KMnO4 溶液(或0.0l mol.L-1 溴水) | 若溶液紫色(或橙色)褪去,证明气体产物中含有SO2,若溶液紫色(或橙色)无明显变化,证明气体产物中不含SO2 |
故答案为:A
(2)从溶液中得到氢氧化铁沉淀,要过滤、洗涤;从氢氧化铁到氧化铁,要灼烧,
故答案为:过滤、洗涤、灼烧
(3)Fe2O3中铁的质量为:
| 2×56 |
| 160 |
| 250.00mL |
| 25.00mL |
| 2.24g |
| 32.0g |
故答案为:70%
点评:本题主要考查了二氧化硫和二氧化硫的检验,掌握两者性质的差异是解题的关键,题目综合性较强,难度中等.

练习册系列答案
相关题目
浙江即将实施“一核、两翼、三圈、九区、多岛”为空间布局的“海洋强国战略”和“东部地区率先发展战略”.下列说法不正确的是( )
| A、大力发展火力发电,解决浙江电力紧张问题,有利于发展节能减排、低碳经济 |
| B、从海带中提取碘单质的过程涉及氧化还原反应 |
| C、海洋经济专属区的资源开发可获得Na、Mg、K等金属 |
| D、可大力发展氯碱工业,建成氯碱、造纸、肥皂、玻璃、高纯硅等“资源-产品-再生资源”的产业链,走循环经济道路 |
室内空气污染的主要来源之一是含有的放射性元素的天然石材等,其常被称为“隐形杀手”,该污染物是( )
| A、甲烷 | B、甲醛 | C、一氧化碳 | D、氡 |
下列说法正确的是( )
| A、SO2、NOx、CO2、固体颗粒物同为大气污染物 |
| B、SO2对环境的主要影响是容易形成光化学烟雾,危害市民健康 |
| C、收集的酸雨在放置一段时间后pH会增大 |
| D、臭氧层是地球生命的保护伞,氟氯烃在破坏臭氧层时起到催化剂作用 |
在d轨道中电子排布成 而不能排布成
而不能排布成 其最直接的根据是( )
其最直接的根据是( )
 而不能排布成
而不能排布成 其最直接的根据是( )
其最直接的根据是( )| A、能量最低原理 |
| B、泡利原理 |
| C、原子轨道构造原理 |
| D、洪特规则 |
下列元素电负性最大的是( )
| A、C | B、N | C、O | D、F |