题目内容
16.有Al、CuO、Fe2O3组成的混合物共10.0g,放入500mL 某浓度的盐酸中,混合物完全溶解,当再加入250mL、2.00mol•L-1的NaOH溶液时,得到沉淀最多.上述盐酸的浓度为( )| A. | 1.00 mol•L-1 | B. | 0.500 mol•L-1 | C. | 2.00 mol•L-1 | D. | 3.00 mol•L-1 |
分析 Al、CuO、Fe2O3组成的混合物共与盐酸反应生成氯化铝、氯化铜、氯化铁,盐酸可能有剩余,向反应后溶液中加入NaOH溶液,得到的沉淀最大应生成氢氧化铝、氢氧化铜、氢氧化铁,此时溶液中溶质为NaCl,根据氯离子守恒有n(HCl)=n(NaCl),根据钠离子守恒有n(NaCl)=n(NaOH),再根据c=$\frac{n}{V}$计算盐酸的浓度.
解答 解:Al、CuO、Fe2O3组成的混合物共与盐酸反应生成氯化铝、氯化铜、氯化铁,盐酸可能有剩余,
向反应后溶液中加入NaOH溶液,得到的沉淀最多,应满足恰好反应生成氢氧化铝、氢氧化铜、氢氧化铁,此时溶液中溶质为NaCl,
根据钠离子守恒可得:n(NaCl)=n(NaOH)=0.250L×2.00mol/L=0.5mol,
根据氯离子守恒可得:n(HCl)=n(NaCl)=0.5mol,
故该元素的物质的量浓度=$\frac{0.5mol}{0.5L}$=1mol/L,
故选A.
点评 本题考查了有关混合物反应的计算,题目难度中等,注意掌握质量守恒定律在化学计算中的应用方法,本题中明确反应后的溶质组成为解答关键,试题侧重考查学生的分析、理解能力.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
4.“市民利益无小事,食品安全是大事”,袋装食品更受各部门的关注,为了延长食品的保质期,在袋装食品的袋中往往放入一小包上面标有“不可食用”的字,则这包中装的物质可能是( )
| A. | 食盐和味精 | B. | 味精和糖 | C. | 铁粉和硅胶 | D. | 铁粉和碱石灰 |
11.下列反应的离子方程式正确的是( )
| A. | 碳酸氢镁溶液中加入足量的烧碱:HCO3-+OH-=CO32-+H2O | |
| B. | 铝粉投入到烧碱溶液中:Al+2OH-=AlO2-+H2↑ | |
| C. | 铁粉加到足量的稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | |
| D. | 向FeSO4和KSCN溶液滴加酸化的H2O2溶液,立即变红:2Fe2++H2O2+2H+=2Fe3++2H2O,Fe3++3SCN-=Fe(SCN)3 |
8. 某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池,得到的实验数据如表所示:(已知果汁是显酸性的)
某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池,得到的实验数据如表所示:(已知果汁是显酸性的)
(1)该实验的目的是探究水果种类和电极间距离对水果电池电流大小的影响.
(2)能表明水果种类对电流大小有影响的实验编号是②和③.
(3)如图所示的装置中,负极的电极反应式为Zn-2e-=Zn2+,正极附近区域的C(H+)将减少 (填“增大”“减小”“不变”),总反应离子方程式为Zn+2H+=Zn2++H2↑
(4)若反应过程中共转移1.2mol电子,则生成气体在标准状态下的体积为13.44L.
 某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池,得到的实验数据如表所示:(已知果汁是显酸性的)
某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池,得到的实验数据如表所示:(已知果汁是显酸性的)| 实验编号 | 水果种类 | 电极间距离 | 电流大小/μA |
| ① | 西红柿 | 1 | 98.7 |
| ② | 西红柿 | 2 | 72.5 |
| ③ | 苹果 | 2 | 27.2 |
(2)能表明水果种类对电流大小有影响的实验编号是②和③.
(3)如图所示的装置中,负极的电极反应式为Zn-2e-=Zn2+,正极附近区域的C(H+)将减少 (填“增大”“减小”“不变”),总反应离子方程式为Zn+2H+=Zn2++H2↑
(4)若反应过程中共转移1.2mol电子,则生成气体在标准状态下的体积为13.44L.
5.下列配对正确的是( )
| A. | 同素异形体:金刚石和石墨 | B. | 同位素:H2和D2 | ||
| C. | 同分异构体:H和D | D. | 同系物:正丁烷和异丁烷 |

 .
. 等.
等.
 为原料制备化合物X(结构简式见图
为原料制备化合物X(结构简式见图 )
) “摩尔盐”1(NH4)2Fe(SO4)2•6H2O]是分析化学中的重要试剂.已知:摩尔盐隔绝空气加热至500℃时可完全分解.某学习小组欲探究其分解产物.
“摩尔盐”1(NH4)2Fe(SO4)2•6H2O]是分析化学中的重要试剂.已知:摩尔盐隔绝空气加热至500℃时可完全分解.某学习小组欲探究其分解产物.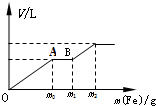 往一个盛有100mL的硝酸(浓度为1.0mol/L)和硫酸(浓度为2.0mol/L)的混和稀溶液中逐渐加入铁粉至反应停止,生成的气体与所加入铁粉的质量如下所示
往一个盛有100mL的硝酸(浓度为1.0mol/L)和硫酸(浓度为2.0mol/L)的混和稀溶液中逐渐加入铁粉至反应停止,生成的气体与所加入铁粉的质量如下所示