题目内容
在密闭容器中进行反应:2A(g)+B(g)?3C(g)+Q(Q>0).下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )


分析:A.正反应放热,升高温度,反应速率加快,平衡向逆反应方向移动,平衡时二氧化硫的含量减小;
B.缩小容器体积,压强增大,正逆反应速率都增大,但速率相等,平衡不移动;
C.增大反应物的浓度瞬间,正反速率增大,逆反应速率不变,之后逐渐增大;
D.曲线表示平衡常数与温度的关系,曲线上各点都是平衡点.
B.缩小容器体积,压强增大,正逆反应速率都增大,但速率相等,平衡不移动;
C.增大反应物的浓度瞬间,正反速率增大,逆反应速率不变,之后逐渐增大;
D.曲线表示平衡常数与温度的关系,曲线上各点都是平衡点.
解答:解:A.图Ⅰ中乙到达平衡时间较短,乙的温度较高,正反应放热,升高温度,平衡向逆反应方向移动,SO3的转化率减小,乙的温度较高,故A错误;
B.图Ⅱ在t0时刻正逆反应速率都增大,但仍相等,平衡不发生移动,该反应前后气体的体积不变,应是缩小体积或加入催化剂的原因,故B正确;
C.增大反应物的浓度瞬间,正反速率增大,逆反应速率不变,之后逐渐增大,图Ⅲ改变条件瞬间,正、逆速率都增大,正反应速率增大较大,平衡向正反应移动,该反应正反应是体积不变的放热反应,应是同时不同等程度增大反应物与生成的浓度,故C错误;
D.曲线表示平衡常数与温度的关系,曲线上各点都是平衡点,故D错误;
故选B.
B.图Ⅱ在t0时刻正逆反应速率都增大,但仍相等,平衡不发生移动,该反应前后气体的体积不变,应是缩小体积或加入催化剂的原因,故B正确;
C.增大反应物的浓度瞬间,正反速率增大,逆反应速率不变,之后逐渐增大,图Ⅲ改变条件瞬间,正、逆速率都增大,正反应速率增大较大,平衡向正反应移动,该反应正反应是体积不变的放热反应,应是同时不同等程度增大反应物与生成的浓度,故C错误;
D.曲线表示平衡常数与温度的关系,曲线上各点都是平衡点,故D错误;
故选B.
点评:本题考查外界条件对化学反应速率、化学平衡的影响,题目难度中等,答题时注意:(1)若t0时刻无断点,则平衡移动肯定是改变某一物质的浓度导致.(2)若t0时刻有断点,则平衡移动可能是由于以下原因所导致:①同时不同程度地改变反应物(或生成物)的浓度②改变反应体系的压强;③改变反应体系的温度.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
在密闭容器中进行反应:X2(g)+Y2(g)?2Z(g)已知X2、Y2、Z的起始浓度分别为0.1mol?L-1、0.3mol?L-1、0.2mol?L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A、Z为0.35mol?L-1 | B、Y2为0.45mol?L-1 | C、X2为0.2 mol?L-1 | D、Z为0.4mol?L-1 |
(双选).在密闭容器中进行反应X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol.L-1、0.3mol.L-1、0.2mol.L-1,在一定条件下当反应达到平衡时,各物质的浓度有可能是( )
| A、Z为0.3mol.L-1, | B、X2为0.2mol.L-1, | C、Y2为0.3mol.L-1, | D、Z为0.4mol.L-1, |
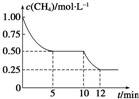 在密闭容器中进行反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)的变化如图所示.下列判断不正确的是( )
在密闭容器中进行反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)的变化如图所示.下列判断不正确的是( )| A、10min时,改变的外界条件可能是升高温度 | B、0~10min内,v(H2)=0.15mol?L-1?min-1 | C、恒温下,缩小容器体积,一段时间内v逆>v正 | D、12min时,反应达平衡的本质原因是气体总质量不再变化 |
 (2012?石家庄一模)常温下,A为无色无味液体,B为淡黄色粉末,D、E、G、W为气体,且G的相对分子质量比D大16,各物质间的转化关系如图所示:
(2012?石家庄一模)常温下,A为无色无味液体,B为淡黄色粉末,D、E、G、W为气体,且G的相对分子质量比D大16,各物质间的转化关系如图所示: