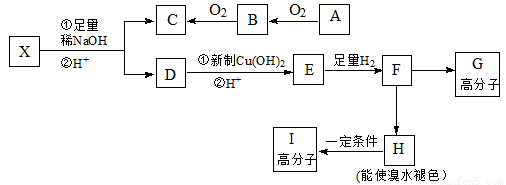
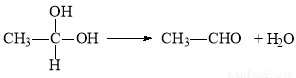
题目内容
下图是给病人输液用的氯化钠注射溶液的标签。(友情提示:若要用到溶液密度,可用水的密度进行计算)

(1)氯化钠的摩尔质量____________________
(2)该注射溶液的物质的量浓度为 mol/L。(保留两位有效数字)
(3)某同学配制了1000mL氯化钠注射溶液,为测定所配氯化钠注射液是否达标,取该氯化钠注射液130 mL于烧杯中,然后滴入足量的AgNO3溶液,充分反应后,过滤得到白色沉淀2.87g。请你通过计算判断该氯化钠注射液是否符合上述要求,写出计算过程。
(保留两位有效数字)
(1)58.5 g/mol;(2)0.15;
(3)设氯化钠的物质的量为n mol
NaCl + AgNO3 = AgCl↓ + NaNO3
1mol 143.5g
n(NaCl) 2.87g
1mol/ n(NaCl) = 143.5g/2.87g
n(NaCl) = 0.02mol(1分) c(NaCl) = 0.02mol/0.13L = 0.15mol/L
所以该溶液符合要求
【解析】
试题分析:(1)摩尔质量的单位为g/mol,数值与式量相同,所以氯化钠的摩尔质量为58.5 g/mol;(2) = 0.15 mol/L;
= 0.15 mol/L;
(3)设氯化钠的物质的量为n mol
NaCl + AgNO3 = AgCl↓ + NaNO3
1mol 143.5g
n(NaCl) 2.87g
1mol/ n(NaCl) = 143.5g/2.87g
n(NaCl) = 0.02mol(1分) c(NaCl) = 0.02mol/0.13L = 0.15mol/L
所以该溶液符合要求。
考点:本题考查化学计算。

 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案温度700℃ 时,向容积为2L的密闭容器中充入一定量的CO和H2O发生反应
CO(g)+H2O(g)  CO2(g)+H2(g) ,反应过程中测定的部分数据见下表(表中t1<t2)。
CO2(g)+H2(g) ,反应过程中测定的部分数据见下表(表中t1<t2)。
反应时间/min | n(CO)/mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是
A.反应在t1min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
C.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
D.保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol
二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上以CO和H2为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
① CO(g) + 2H2(g) CH3OH(g) △H1=-Q1 kJ·mol-1
CH3OH(g) △H1=-Q1 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+ H2O(g) △H2=-Q2 kJ·mol-1
CH3OCH3(g)+ H2O(g) △H2=-Q2 kJ·mol-1
③ CO(g)+ H2O(g) CO2(g) + H2(g) △H3=-Q3 kJ·mol-1
CO2(g) + H2(g) △H3=-Q3 kJ·mol-1
回答下列问题:
(1)新工艺的总反应3H2(g)+ 3CO(g) CH3OCH3(g)+ CO2(g)的热化学方程式为_________。
CH3OCH3(g)+ CO2(g)的热化学方程式为_________。
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g) + 2H2(g) CH3OH (g) △H
CH3OH (g) △H
下表所列数据是该反应在不同温度下的化学平衡常数(Κ)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
① 由表中数据判断ΔH 0 (填“ >”、“=”或“<”)。能够说明某温度下该反应是平衡状态的是
A.体系的压强不变
B.密度不变
C.混合气体的相对分子质量不变
D.c(CO)=c(CH3OH)
② 某温度下,将 2mol CO和 6mol H2 充入2L的密闭容器中,充分反应 10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K= 。
(3)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,在恒容密闭容器中冲入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,在恒容密闭容器中冲入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如下图。

请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为 。
②在实验Ⅲ中改变条件为采用比实验Ⅰ更高的温度,请在下图中画出实验I和实验Ⅲ中NH3浓度随时间变化的示意图。