题目内容
6.有关物质的转化关系如图所示(部分物质和条件已略去).A为含两种元素的化合物.常温常压下,B为无色气体单质,C为能使品红溶液褪色的无色气体化合物,D为红色固体氧化物,K、L为常见金属单质,G溶液为蓝色,J为常见的无色液体.
请回答下列问题:
(1)J的电子式为
 .
.(2)A中金属元素的质量分数为46.7%,则A的化学式为FeS2.
(3)F和K在加热时反应的化学方程式为Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(4)H和K反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+.
分析 A为含两种元素的化合物,B为无色气体单质,A、B在高温下反应生成C和D,C为能使品红溶液褪色的无色气体化合物,C应为SO2,D为红色固体氧化物,应为Fe2O3,所以B为O2,A为含有铁和硫元素的化合物,A中金属元素的质量分数为46.7%,所以A的化学式为FeS2,C与氧气反应生成E为SO3,J为常见的无色液体,应为H2O,E与水反应生成F为H2SO4,K、L为常见金属单质,G溶液为蓝色,所以K为Cu,铜与浓硫酸反应生成G为CuSO4,氧化铁与硫酸反应生成H为Fe2(SO4)3,H与铜反应生成I为FeSO4,铁与硫酸铜反应生成硫酸亚铁,所以L为Fe,据此答题.
解答 解:A为含两种元素的化合物,B为无色气体单质,A、B在高温下反应生成C和D,C为能使品红溶液褪色的无色气体化合物,C应为SO2,D为红色固体氧化物,应为Fe2O3,所以B为O2,A为含有铁和硫元素的化合物,A中金属元素的质量分数为46.7%,所以A的化学式为FeS2,C与氧气反应生成E为SO3,J为常见的无色液体,应为H2O,E与水反应生成F为H2SO4,K、L为常见金属单质,G溶液为蓝色,所以K为Cu,铜与浓硫酸反应生成G为CuSO4,氧化铁与硫酸反应生成H为Fe2(SO4)3,H与铜反应生成I为FeSO4,铁与硫酸铜反应生成硫酸亚铁,所以L为Fe,
(1)J为H2O,J的电子式为 ,
,
故答案为: ;
;
(2)根据上面的分析可知,A的化学式为FeS2,
故答案为:FeS2;
(3)铜 与浓硫酸在加热时反应的化学方程式为 Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(4)H为Fe2(SO4)3,K为Cu,H和K反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+,
故答案为:2Fe3++Cu=2Fe2++Cu2+.
点评 本题考查无机物的推断,题目难度中等,注意根据相关物质的颜色以及转化关系作为该题的突破口,学习中注意相关知识的掌握.

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案| A. | 澄清的石灰水跟稀硝酸反应:Ca(OH)2+2H+=Ca2++2H2O | |
| B. | 氢氧化钡溶液和硫酸铜溶液反应:Ba2++SO42-=BaSO4↓ | |
| C. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O | |
| D. | 往澄清石灰水中通入少量二氧化碳气体:CO2+OH-=HCO3- |
| A. | $\frac{39m}{V}$mol•L-1 | B. | $\frac{2m}{39V}$mol•L-1 | C. | $\frac{m}{39V}$mol•L-1 | D. | $\frac{m}{78V}$mol•L-1 |
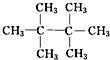
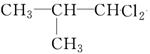 、
、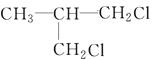 、
、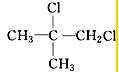 .
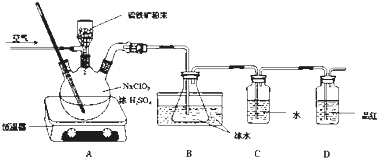
.
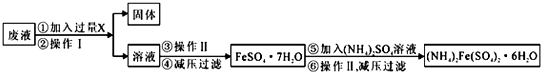
 尿素[H2NCONH2]既是一种非常重要的高氮化肥,又是多种有机、无机产品的生产原料.工业上以合成氨厂的NH3和CO2为原料生产尿素.请回答下列问题:
尿素[H2NCONH2]既是一种非常重要的高氮化肥,又是多种有机、无机产品的生产原料.工业上以合成氨厂的NH3和CO2为原料生产尿素.请回答下列问题: