题目内容
8.如图甲、乙是电化学实验装置.
(1)若甲、乙两烧杯中均盛有饱和NaCl溶液.
①甲中石墨棒上的电极反应式O2+2H2O+4e-═4OH-,电子的移动方向为由铁经导线移向石墨.
②乙中总反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,Cl-移向C电极(填Fe或C).
③将湿润的淀粉-KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2.若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为:5Cl2+I2+6H2O═10HCl+2HIO3.
(2)如果起始时乙中盛有200mL pH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入CuO的质量为0.8g.
分析 (1)①甲为原电池装置,铁作负极,则石墨作正极,正极上氧气得电子;
②乙为电解装置,由电子流向可知石墨为阳极,阳极上氯离子放电,阴极上氢离子放电;
③Cl2氧化了生成的I2,Cl元素的化合价降低,由电子守恒及Cl2和I2的物质的量之比为5:1来判断反应后I元素的化合价,以此来书写化学反应;
(2)根据电解硫酸铜的化学反应及元素守恒来判断加入的物质使溶液恢复到电解前的状态,再由溶液的pH的变化计算加入物质的质量.
解答 解:(1)①甲为原电池装置,石墨棒是正极,铁是负极,正极上氧气得电子发生还原反应,反应为2H2O+O2+4e-═4OH-,电子的移动方向为:负极到正极,即由铁经导线移向石墨,
故答案为:2H2O+O2+4e-═4OH-;由铁经导线移向石墨;
②乙为电解装置,由电子流向可知石墨为阳极,阳极上氯离子放电,阴极上氢离子放电,则电解反应为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$ H2↑+Cl2↑+2OH-,在电解池中,阴离子移向
阳极,即氯离子流向C电极.
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-;C;
③Cl2氧化了生成的I2,Cl元素的化合价降低,生成盐酸,反应中Cl2和I2的物质的量之比为5:1,设I元素的化合价为x,则5×2×1=1×2×x,解得x=+5,则生成碘酸,所以发生的化学反应为5Cl2+I2+6H2O═10HCl+2HIO3,
故答案为:5Cl2+I2+6H2O═10HCl+2HIO3;
(2)由2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,要使溶液恢复原状态,可加入CuO(或CuCO3),一段时间后溶液的pH变为1,则c(H+)=0.1mol/L-10-5mol/L=0.1mol/L,n(H+)=0.2L×0.1mol/L=0.02mol,则由电解反应可知析出的Cu的物质的量为0.01mol,由Cu原子守恒可知,m(CuO)=0.01mol×80g/mol=0.8g,
故答案为:0.8g.
点评 本题考查原电池与电解池的工作原理,明确离子放电顺序、电极反应式的书写即可解答,难度不大.

| A. | Mg变为MgO时化合价升高,故Mg在该反应中作还原剂 | |
| B. | 在反应2H2S+SO2═3S+2H2O中,氧化产物和还原产物都是S | |
| C. | 凡是氧化还原反应都有利于生产、生活 | |
| D. | 在反应2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑中,H2O既是还原剂又是氧化剂 |
| A. | 该混合气体体积为8.96L | |
| B. | 该混合气体中CO、H2的物质的量之比为1:1 | |
| C. | 表示CO燃烧热的热化学方程式为2CO(g)+O2(g)═2CO2(g)△H=-565.6kJ•mol-1 | |
| D. | 氢气燃烧的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8kJ•mol-1 |

| A. | 丁子香酚分子式为C10H12O2 | |
| B. | 丁子香酚所有碳原子一定在同一个平面上 | |
| C. | 丁子香酚是苯酚的同系物 | |
| D. | 丁子香酚可以发生加成、取代、氧化、加聚反应 |
| A. | 3.4gNH3中含有电子数为2NA | |
| B. | 0.1mol/L CuSO4溶液中含有的SO42-数目为0.1NA | |
| C. | 常温常压下,2.24L O3中含有的氧原子数为0.3NA | |
| D. | 足量的MnO2与50mL 8mol/L浓盐酸充分反应后,生成Cl2的分子数为0.1NA |
| A. | 该电池工作时,甲醇发生燃烧,将热能转化为电能 | |
| B. | 当介质为碱性溶液时,其负极反应为:CH3OH-6e-+H2O═CO2+6H+ | |
| C. | 当介质为酸性溶液时,其负极反应为:O2+4e-+4H+═2H2O | |
| D. | 每摩尔甲醇被氧化时,转移电子的物质的量是6mol |

下列有关叙述正确的是( )
| A. | 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 | |
| B. | 可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3 溶液反应 | |
| D. | 对乙酰氨基酚分子中核磁共振氢谱出现五组峰,且峰面积之比为3:1:2:2:1 |
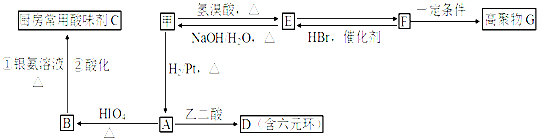
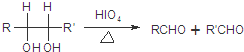
 .
. .
.
 ,PBS的结构简式是
,PBS的结构简式是 .
.

 (R1、R2、R3为烃基或氢原子)
(R1、R2、R3为烃基或氢原子) .
. .
.