题目内容
8.已知下列热化学方程式CH4(g)+2O2(g)→CO2(g)+2H2O(l)+Q1
2H2(g)+O2(g)→2H2O(g)+Q2
2H2(g)+O2(g)→2H2O(l)+Q3
取体积比为4:1的甲烷和氢气的混合气体共11.2L(S.T.P),完全燃烧后恢复到原状态,放出的热量是( )
| A. | 0.4Q1+0.05Q2 | B. | 0.4Q1+0.05Q3 | C. | 0.4Q1+0.1Q3 | D. | 0.4Q1+0.2Q2 |
分析 根据n=$\frac{V}{{V}_{m}}$计算混合气体的物质的量,根据体积比较计算甲烷、氢气的物质的量,再根据热化学方程式计算燃烧放出的热量.
解答 解:标准状况下11.2L甲烷和氢气混合气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,甲烷和氢气的体积之比为4:1,所以甲烷的物质的量为:0.5mol×$\frac{4}{5}$=0.4mol,氢气的物质的量为0.5mol-0.4mol=0.1mol,
由CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-Q1 kJ•mol-1 可知,
0.4mol甲烷燃烧放出的热量为0.4mol×Q1 kJ•mol-1=0.4Q1 kJ,
由2H2(g)+O2(g)→2H2O(l)+Q3
可知,
0.1mol氢气燃烧放出的热量为$\frac{0.1mol}{2}×{Q}_{3}$Q3kJ•mol-1=0.05Q3kJ,
所以放出的热量为0.4Q1kJ+0.05Q3kJ=(0.4Q1+0.05Q3)kJ,
故选:B.
点评 本题考查根据热化学方程式进行的有关反应热的计算,难度不大,理解热化学方程式的意义是关键,注意室温下水为液体.

练习册系列答案
相关题目
19.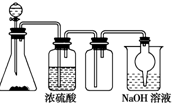 如图是一套实验室制取气体的装置,用于发生、干燥、收集和吸收有害气体,下列各组物质能利用这套装置进行实验的是
如图是一套实验室制取气体的装置,用于发生、干燥、收集和吸收有害气体,下列各组物质能利用这套装置进行实验的是
( )
 如图是一套实验室制取气体的装置,用于发生、干燥、收集和吸收有害气体,下列各组物质能利用这套装置进行实验的是
如图是一套实验室制取气体的装置,用于发生、干燥、收集和吸收有害气体,下列各组物质能利用这套装置进行实验的是( )
| A. | MnO2和浓盐酸 | B. | Na2SO3(s)和较浓H2SO4 | ||
| C. | Cu片和浓HNO3 | D. | 浓氨水和生石灰 |
16.加碘盐中碘元素的存在形式是( )
| A. | I2 | B. | KIO3 | C. | KI |
3.下列排列顺序正确的是( )
| A. | 粒子半径:F-<Mg2+<Al3+ | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH)2>NaOH |
13.某元素原子最外层上只有两个电子,该元素( )
| A. | 一定是金属元素 | |
| B. | 一定能和氢氧化钠溶液反应生成氢气 | |
| C. | 一定是ⅡA族元素 | |
| D. | 可能是金属元素,也可能不是金属元素 |
17.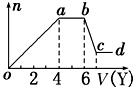 某无色稀溶液X中,可能含有下表所列离子中的某几种.
某无色稀溶液X中,可能含有下表所列离子中的某几种.
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.
(1)若Y是盐酸,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是AlO2-、SiO32-,ab段发生反应的离子是CO32-,bc段发生反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
(2)若Y是NaOH溶液,则X中一定含有的阳离子是Al3+、Mg2+、NH4+,其物质的量之比为2:1:4,ab段反应的离子方程式为NH4++OH-═NH3•H2O.
 某无色稀溶液X中,可能含有下表所列离子中的某几种.
某无色稀溶液X中,可能含有下表所列离子中的某几种.| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
(1)若Y是盐酸,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是AlO2-、SiO32-,ab段发生反应的离子是CO32-,bc段发生反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
(2)若Y是NaOH溶液,则X中一定含有的阳离子是Al3+、Mg2+、NH4+,其物质的量之比为2:1:4,ab段反应的离子方程式为NH4++OH-═NH3•H2O.


 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点. 盐泥是氯碱工业中的废渣,主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐).实验室以盐泥为原料制取MgSO4•7H2O的实验过程如下:
盐泥是氯碱工业中的废渣,主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐).实验室以盐泥为原料制取MgSO4•7H2O的实验过程如下: