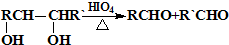题目内容
下列物质中,所含化学键种类最多的是( )
| A、NaOH |
| B、NH4Cl |
| C、CH3COONH4 |
| D、HC≡CH |
考点:化学键
专题:化学键与晶体结构
分析:一般来说,活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性共价键,不同非金属元素之间易形成极性共价键,含有孤电子对和含有空轨道的原子之间易形成配位键,铵根离子和酸根离子之间易形成离子键,据此分析解答.
解答:
解:A.NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在极性键,所以有两种化学键;
B.氯化铵中铵根离子和氯离子之间存在离子键、铵根离子中N原子和H原子之间存在极性键,其中一个是配位键,有3中化学键;
C.醋酸铵中铵根离子和醋酸根离子之间存在离子键、醋酸根离子中存在极性键和非极性键、铵根离子中存在极性键和配位键,所以一共有4种化学键;
D.乙炔分子中只存在极性键和非极性键,所以有两种化学键;
通过以上分析知,含有化学键种类最多的是醋酸铵,故选C.
B.氯化铵中铵根离子和氯离子之间存在离子键、铵根离子中N原子和H原子之间存在极性键,其中一个是配位键,有3中化学键;
C.醋酸铵中铵根离子和醋酸根离子之间存在离子键、醋酸根离子中存在极性键和非极性键、铵根离子中存在极性键和配位键,所以一共有4种化学键;
D.乙炔分子中只存在极性键和非极性键,所以有两种化学键;
通过以上分析知,含有化学键种类最多的是醋酸铵,故选C.
点评:本题考查化学键,侧重考查基本概念,知道离子键、共价键、配位键概念即可解答,注意这几个概念的区别,注意配位键也属于化学键,为易错点.

练习册系列答案
相关题目
短周期相邻的三种元素,它们的最外层电子数之和为16,电子层数之和为7.不属于这三种元素的是( )
| A、S | B、O | C、N | D、P |
下列反应中,观察不到颜色变化的是( )
| A、往氨水中滴加酚酞 |
| B、往稀硫酸中通入氨气 |
| C、往品红溶液中通人足量二氧化硫气体 |
| D、氯气通入淀粉碘化钾溶液中 |
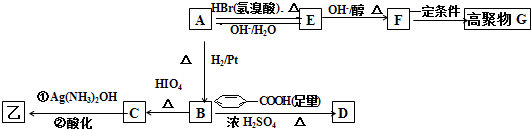
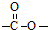 结构的基团,B在HIO4存在并加热时只生成一种产物C,下列为各相关反应的信息和转化关系:
结构的基团,B在HIO4存在并加热时只生成一种产物C,下列为各相关反应的信息和转化关系: