题目内容
15.0.01摩尔的氯化铬(CrCl3.6H2O)在水溶液中用过量的AgNO3处理,只产生2.87g的氯化银沉淀,缓慢加热将产生的水蒸气通入碱石灰中只增重0.18克,通过计算确定氯化铬(CrCl3.6H2O)的化学式.分析 氯化铬(CrCl3•6H2O)中的阴离子氯离子能和银离子反应生成氯化银沉淀,注意配体中的氯原子不能和银离子反应,根据氯化铬(CrCl3•6H2O)和氯化银物质的量的关系式计算氯离子个数,慢加热将产生的水蒸气通入碱石灰中只增重0.18克,为结晶水的质量,计算从而确定氯化铬(CrCl3•6H2O)的化学式.
解答 解:n(AgCl)=$\frac{2.87g}{143.5g/mol}$=0.2mol,氯化铬(CrCl3•6H2O)和氯化银的物质的量之比是1:2,根据氯离子守恒知,一个氯化铬(CrCl3•6H2O)化学式中含有2个氯离子,剩余的1个氯离子是配原子,缓慢加热将产生的水蒸气通入碱石灰中只增重0.18克,n(H2O)=$\frac{0.18g}{18g/mol}$=0.01mol,说明1mol配合物含有1mol结晶水,则5mol水为配体,则分子式为[CrCl(H2O)5]Cl2•H2O.
答:氯化铬(CrCl3.6H2O)的化学式为[CrCl(H2O)5]Cl2•H2O.
点评 本题考查了配合物的成键情况,为高频考点,侧重于学生的分析、计算能力的考查,难度不大,注意:该反应中,配合物中配原子不参加反应,只有阴离子参加反应,为易错点.

练习册系列答案
 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
5.镍是有机合成的重要催化剂.某化工厂有含镍催化剂废品(主要成分是镍,杂质是铁、铝单质及其化合物,少量难溶性杂质).某学习小组设计如下流程利用含镍催化剂废品制备硫酸镍晶体:
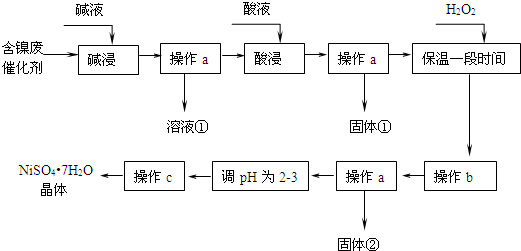
几种难溶碱开始沉淀和完全沉淀的pH:
回答下列问题:
(1)溶液①中含金属元素的离子是AlO2-.
(2)用离子方程式表示加入双氧水的目的2Fe2++H2O2+2H+=2Fe3++2H2O.双氧水可以用下列物质替代的是A.
A.氧气 B.漂液 C.氯气 D.硝酸
(3)操作b调节溶液范围为3.2-7.1,其目的是除去Fe3+.
(4)操作a和c需要共同的玻璃仪器是玻璃棒.上述流程中,防止浓缩结晶过程中Ni2+水解的措施是调节溶液pH为2-3.
(5)如果加入双氧水量不足或“保温时间较短”,对实验结果的影响是产品中混有绿矾.设计实验证明产品中是否含“杂质”(不考虑硫酸镍影响):取少量样品溶于蒸馏水,滴加酸性高锰酸钾溶液,若溶液紫色褪去,则产品中含有Fe2+.

几种难溶碱开始沉淀和完全沉淀的pH:
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(1)溶液①中含金属元素的离子是AlO2-.
(2)用离子方程式表示加入双氧水的目的2Fe2++H2O2+2H+=2Fe3++2H2O.双氧水可以用下列物质替代的是A.
A.氧气 B.漂液 C.氯气 D.硝酸
(3)操作b调节溶液范围为3.2-7.1,其目的是除去Fe3+.
(4)操作a和c需要共同的玻璃仪器是玻璃棒.上述流程中,防止浓缩结晶过程中Ni2+水解的措施是调节溶液pH为2-3.
(5)如果加入双氧水量不足或“保温时间较短”,对实验结果的影响是产品中混有绿矾.设计实验证明产品中是否含“杂质”(不考虑硫酸镍影响):取少量样品溶于蒸馏水,滴加酸性高锰酸钾溶液,若溶液紫色褪去,则产品中含有Fe2+.
6.有NaCl、FeCl2、FeCl3、MgCl2四种溶液,用一种试剂就可把它们鉴别开来,这种试剂是( )
| A. | 盐酸 | B. | 烧碱溶液 | C. | AgNO3溶液 | D. | KSCN溶液 |
10.有关晶体的结构如图所示,下列说法中不正确的是( )


| A. | 在NaCl晶体中,距Na+最近的Cl-形成正八面体 | |
| B. | 在CaF2晶体中,Ca2+、F-的配位数分别是4、8 | |
| C. | 在金刚石晶体中,碳原子与碳碳键个数的比为1:2 | |
| D. | 该气态团簇分子的分子式为EF或FE |
20.某烯烃的结构简式为 有甲、乙、丙、丁四位同学分别将其命名为:2甲基4乙基4戊烯;2异丁基1丁烯;2,4二甲基3己烯;4甲基2乙基1戊烯,下面对4位同学的命名判断正确的是( )
有甲、乙、丙、丁四位同学分别将其命名为:2甲基4乙基4戊烯;2异丁基1丁烯;2,4二甲基3己烯;4甲基2乙基1戊烯,下面对4位同学的命名判断正确的是( )
 有甲、乙、丙、丁四位同学分别将其命名为:2甲基4乙基4戊烯;2异丁基1丁烯;2,4二甲基3己烯;4甲基2乙基1戊烯,下面对4位同学的命名判断正确的是( )
有甲、乙、丙、丁四位同学分别将其命名为:2甲基4乙基4戊烯;2异丁基1丁烯;2,4二甲基3己烯;4甲基2乙基1戊烯,下面对4位同学的命名判断正确的是( )| A. | 甲的命名中主链选择是错误的 | |
| B. | 乙的命名中对主链碳原子的编号是错误的 | |
| C. | 丙的命名中主链选择是正确的 | |
| D. | 丁的命名是正确的 |
7.如表实验中,所采取的分离方法与对应原理都正确的是( )
| 选项 | 目的 | 分离方法 | 原理 |
| A | 除去Fe(OH)3胶体中的FeCl3 | 过滤 | 分散质微粒的大小不同 |
| B | 除去纯碱中的碳酸氢铵 | 加热 | 稳定性不同 |
| C | 分离KNO3和NaCl | 重结晶 | KNO3的溶解度大于NaCl |
| D | 分离食用油和汽油 | 分液 | 食用油和汽油的密度不同 |
| A. | A | B. | B | C. | C | D. | D |
5.某些共价键的键能数据如下表(单位:kJ•mol-1):
(1)把1mol Cl2分解为气态原子时,需要吸收(填“吸收”或“放出”)243KJkJ的能量.
(2 ) 由表中所列化学键形成的单质分子中,最稳定的是H2,最不稳定的是I2;
形成的化合物分子中,最稳定的是HCl,最不稳定的是HI.
| 共价键 | H-H | Cl-Cl | Br-Br | I-I | N≡N | H-Cl | H-I | H-O | H-N |
| 键能 | 436 | 243 | 194 | 153 | 946 | 432 | 299 | 463 | 391 |
(2 ) 由表中所列化学键形成的单质分子中,最稳定的是H2,最不稳定的是I2;
形成的化合物分子中,最稳定的是HCl,最不稳定的是HI.
