题目内容
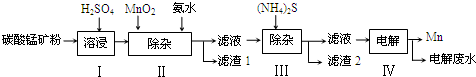
锰是冶炼工业中常用的添加剂.以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如图:
已知25℃,部分物质的溶度积常数如下:
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是 .
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式是 ,加氨水调节溶液的pH为5.0-6.0,以除去Fe3+.
(3)步骤Ⅲ中,滤渣2的主要成分是 .
(4)步骤Ⅳ中,在 (填“阴”或“阳”)极析出Mn,电极反应方程式为 .
(5)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降.进行二级沉降的目的是 .

已知25℃,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式是
(3)步骤Ⅲ中,滤渣2的主要成分是
(4)步骤Ⅳ中,在
(5)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降.进行二级沉降的目的是
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)加稀硫酸时样品中的MnCO3和硫酸反应生成可溶性的MnSO4,并产生二氧化碳和水;
(2)据得失电子守恒有MnO2+2Fe2+--Mn2++2Fe3+,再据电荷守恒有MnO2+2Fe2++4H+--Mn2++2Fe3+,最后据原子守恒得MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(3)由于在第一次过滤之后的滤液中含有Mn2+、Ni2+、Co2+,向其中加入(NH4)2S,根据各物质的溶度积常数可确定有CoS和NiS沉淀(滤渣2)生成;
(4)由于第二次过滤后的滤液中主要含有NiSO4,电解该溶液时Ni2+在阴极上被还原:Mn2++2e-=Mn;
(5)由于将一级沉降得到Mn(OH)2沉淀过滤之后的滤液中还含有Mn2+,以进一步去除废水中的Mn2+,向该滤液中加入适量Na2S,进行二级沉降得到MnS,据溶解积常数确定其溶解度比Mn(OH)2小;
(2)据得失电子守恒有MnO2+2Fe2+--Mn2++2Fe3+,再据电荷守恒有MnO2+2Fe2++4H+--Mn2++2Fe3+,最后据原子守恒得MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(3)由于在第一次过滤之后的滤液中含有Mn2+、Ni2+、Co2+,向其中加入(NH4)2S,根据各物质的溶度积常数可确定有CoS和NiS沉淀(滤渣2)生成;
(4)由于第二次过滤后的滤液中主要含有NiSO4,电解该溶液时Ni2+在阴极上被还原:Mn2++2e-=Mn;
(5)由于将一级沉降得到Mn(OH)2沉淀过滤之后的滤液中还含有Mn2+,以进一步去除废水中的Mn2+,向该滤液中加入适量Na2S,进行二级沉降得到MnS,据溶解积常数确定其溶解度比Mn(OH)2小;
解答:
解:(1)加稀硫酸时样品中的MnCO3和硫酸反应生成可溶性的MnSO4,并产生二氧化碳和水,步骤Ⅰ中,MnCO3与硫酸反应的化学方程式为:MnCO3+H2SO4=MnSO4+CO2↑+H2O;
故答案为:MnCO3+H2SO4=MnSO4+CO2↑+H2O;
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式是据得失电子守恒有MnO2+2Fe2+-Mn2++2Fe3+,再据电荷守恒有MnO2+2Fe2++4H+-Mn2++2Fe3+,最后据原子守恒得,MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(3)由于在第一次过滤之后的滤液中含有Mn2+、Ni2+、Co2+,向其中加入(NH4)2S,根据各物质的溶度积常数可确定有CoS和NiS沉淀(滤渣2)生成;
故答案为:CoS和NiS;
(4)由于第二次过滤后的滤液中主要含有NiSO4,电解该溶液时Ni2+在阴极上被还原:Mn2++2e-=Mn;
故答案为:阴,Mn2++2e-=Mn;
(5)由于将一级沉降得到Mn(OH)2沉淀过滤之后的滤液中还含有Mn2+,以进一步去除废水中的Mn2+,向该滤液中加入适量Na2S,据溶解积常数确定其溶解度比Mn(OH)2小,进行二级沉降得到MnS,以进一步去除废水中的Mn2+;
故答案为:沉降得到MnS,以进一步去除废水中的Mn2+;
故答案为:MnCO3+H2SO4=MnSO4+CO2↑+H2O;
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式是据得失电子守恒有MnO2+2Fe2+-Mn2++2Fe3+,再据电荷守恒有MnO2+2Fe2++4H+-Mn2++2Fe3+,最后据原子守恒得,MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(3)由于在第一次过滤之后的滤液中含有Mn2+、Ni2+、Co2+,向其中加入(NH4)2S,根据各物质的溶度积常数可确定有CoS和NiS沉淀(滤渣2)生成;
故答案为:CoS和NiS;
(4)由于第二次过滤后的滤液中主要含有NiSO4,电解该溶液时Ni2+在阴极上被还原:Mn2++2e-=Mn;
故答案为:阴,Mn2++2e-=Mn;
(5)由于将一级沉降得到Mn(OH)2沉淀过滤之后的滤液中还含有Mn2+,以进一步去除废水中的Mn2+,向该滤液中加入适量Na2S,据溶解积常数确定其溶解度比Mn(OH)2小,进行二级沉降得到MnS,以进一步去除废水中的Mn2+;
故答案为:沉降得到MnS,以进一步去除废水中的Mn2+;
点评:本题考查了物质分离的流程分析,无性质,分离提纯物质的实验设计和本质分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
在标准状况下,气体A的密度为1.25g/L,气体B的相对分子质量为42,A和B的混合气体在相同状况下对H2的相对密度为16.8,则混合气体中A和B的体积比为( )
| A、3:2 | B、2:1 |
| C、2:3 | D、1:2 |
下列变化中,一定需加还原剂才能实现的是( )
| A、CO2→CO32- |
| B、FeCl3→FeCl2 |
| C、C→CO2 |
| D、KMnO4→MnO2 |
 由1mol X气体和1mol Y气体和催化剂放入反应容器中,发生反应X+Y?Z,实验测得Z%随T的变化曲线如图所示:
由1mol X气体和1mol Y气体和催化剂放入反应容器中,发生反应X+Y?Z,实验测得Z%随T的变化曲线如图所示:


