题目内容
5.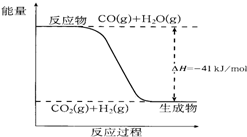 已知一氧化碳与水蒸气反应过程的能量变化如图所示:
已知一氧化碳与水蒸气反应过程的能量变化如图所示:则此反应的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol.
分析 依据图象分析反应物能量高于生成物能量,反应是放热反应,依据反应的热化学方程式标注物质聚集状态和对应焓变的大小.
解答 解:图象分析判断反应物能量高于生成物能量,反应是放热反应,1molCO完全反应放出的热量41KJ,热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41 kJ/mol,
故答案为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41 kJ/mol.
点评 本题考查热化学方程式的书写和盖斯定律应用,图象分析理解是关键,题目较简单.

练习册系列答案
相关题目
15.下列说法错误的是( )
| A. | 同浓度的下列溶液,c(NH4+)大小顺序:(NH4)2SO4>NH4HSO4>NH4Cl>NH4HCO3 | |
| B. | 同浓度的下列溶液,pH值大小顺序:Na2CO3>NaClO>NaHCO3>CH3COONa | |
| C. | 用水冲洗BaSO4比用稀硫酸冲洗损失大 | |
| D. | 用惰性电极电解某溶液,两极分别产生H2和O2,pH值一定升高 |
16.对下列装置图的叙述正确的是( )
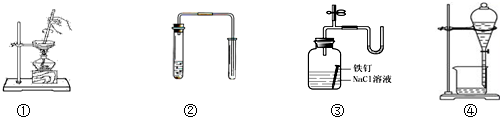

| A. | 装置①可用于加热蒸干氯化铵溶液得到氯化铵晶体 | |
| B. | 装置②可用于铜和稀硝酸制取并收集少量NO | |
| C. | 装置③可用于证明铁生锈氧气参与反应 | |
| D. | 苯萃取碘水中的碘后,从装置④下口放出的是碘的苯溶液 |
13.下列废弃物,不可能直接回收利用的是( )
| A. | 易拉罐 | B. | 塑料拖鞋 | C. | 玻璃白酒瓶 | D. | 医用点滴管 |
10.对于可逆反应N2(g)+3H2(g)?2NH3(g);△H<0,下列研究目的和示意图相符的是( )
| 研究目的 | 温度(T) 对反应的影响 | 压强(p)对平衡常数的影响 | 压强(p)对反应的影响(p2>p1) | 温度(T)对反应的影响(T1>T2) |
| 图示 | 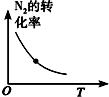 | 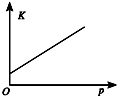 | 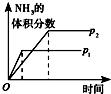 |  |
| A. | A | B. | B | C. | C | D. | D |
17.在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是( )
| A. | 范德华力、范德华力、离子键 | B. | 范德华力、共价键、共价键 | ||
| C. | 范德华力、范德华力、共价键 | D. | 共价键、共价键、共价键 |
14.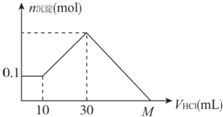 某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,将其一定量溶于水,有沉淀产生,在所得悬浊液中逐滴加入5 mol/L的盐酸,图表示盐酸加入量与沉淀量的变化关系,图中M点表示已加入的盐酸体积,则M点的体积是( )
某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,将其一定量溶于水,有沉淀产生,在所得悬浊液中逐滴加入5 mol/L的盐酸,图表示盐酸加入量与沉淀量的变化关系,图中M点表示已加入的盐酸体积,则M点的体积是( )
 某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,将其一定量溶于水,有沉淀产生,在所得悬浊液中逐滴加入5 mol/L的盐酸,图表示盐酸加入量与沉淀量的变化关系,图中M点表示已加入的盐酸体积,则M点的体积是( )
某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,将其一定量溶于水,有沉淀产生,在所得悬浊液中逐滴加入5 mol/L的盐酸,图表示盐酸加入量与沉淀量的变化关系,图中M点表示已加入的盐酸体积,则M点的体积是( )| A. | 70 mL | B. | 90 mL | C. | 100 mL | D. | 130 mL |
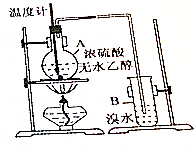 已知乙醇与浓硫酸加热到170℃时可生成乙烯:
已知乙醇与浓硫酸加热到170℃时可生成乙烯: