题目内容
将气体A、B置于容积为2L的密闭容器中,发生如下反应:4A(g)+B(g)═2C(g)反应进行到4s末,测得A为0.5mol,B为0.4mol,C为0.2mol.则下列说法正确的是( )
| A、该时间段C的化学反应速率为0.2mol/(L?s) |
| B、该时间段A的化学反应速率为0.125mol/(L?s) |
| C、该时间段B的化学反应速率为0.05mol/(L?s) |
| D、到4s末时,B的转化率为20% |
考点:化学平衡的计算
专题:化学平衡专题
分析:根据v=
计算v(C),再利用速率之比等于化学计量数之比计算A、B表示的反应速率,转化率=
×100%.
| ||
| △t |
| 消耗量 |
| 起始量 |
解答:
解:A、4s末生成C为0.2mol,故v(C)=
=0.025 mol/(L?S),故A错误;
B、速率之比等于化学计量数之比,故v(A)=2v(C)=2×0.025 mol/(L?S)=0.05 mol/(L?S),故B错误;
C、速率之比等于化学计量数之比,故v(B)=
v(C)=
×0.025 mol/(L?S)=0.0125 mol/(L?S),故C错误;
D、4A(g)+B(g)═2C(g)
0.9 0.5 0
0.4 0.1 0.2
0.5 0.4 0.2
B的转化率=
×100%=20%,故D正确;
故选D.
| ||
| 4s |
B、速率之比等于化学计量数之比,故v(A)=2v(C)=2×0.025 mol/(L?S)=0.05 mol/(L?S),故B错误;
C、速率之比等于化学计量数之比,故v(B)=
| 1 |
| 2 |
| 1 |
| 2 |
D、4A(g)+B(g)═2C(g)
0.9 0.5 0
0.4 0.1 0.2
0.5 0.4 0.2
B的转化率=
| 0.1mol |
| 0.5mol |
故选D.
点评:本题考查化学反应速率反应物转化率的计算,比较基础,可以利用定义法计算,注意对速率规律的理解.

练习册系列答案
相关题目
有关化工生产原理说法正确的是( )
A、工业上制粗硅:SiO2+C
| ||||
B、海水提镁的主要步骤为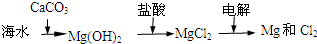 | ||||
C、海水提溴原理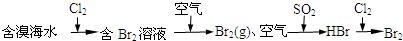 | ||||
| D、硫酸工业的接触室、合成氨工业的合成塔和氯碱工业的电解槽都有热交换器 |
在实验室中,对下列事故或药品的处理正确的是( )
| A、漂白粉长期放置在烧杯中 |
| B、金属钠着火燃烧时,不能用泡沫灭火器灭火,应该用沙子灭火 |
| C、少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
| D、有大量的氯气泄漏时,用碳酸钠溶液浸湿软布蒙面,并迅速离开现场 |
下列说法中,在科学上没有错误的是( )
| A、吸带过滤嘴的香烟,对人体无害 |
| B、长期饮用纯净水,有可能引起一些微量元素的缺乏症 |
| C、纯天然物质配成的饮料,不含任何化学物质 |
| D、调味剂和营养剂加得越多越好 |
室温时,pH=6的盐酸和pH=8的Na2CO3溶液中,水电离出的c(OH-) 分别为x mol?L-1和 y mol?L-1,两者的关系正确的是( )
| A、x=10?2y |
| B、x=102y |
| C、x=y |
| D、x>y |
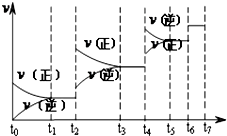 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)