题目内容
某同学对FeCl3的氧化性以及FeSO4的热稳定性进行如下探究:
(1)查阅资料FeSO4高温分解,反应方程式为:2FeSO4
Fe2O3+SO2↑+SO3↑.
①用双线桥标出高温分解FeSO4制备Fe2O3反应中电子转移的方向和数目 .
②为收集SO3并验证SO2,应将气体依次通过浸没在 中的U型管、洗气瓶中的 和NaOH溶液.
(2)实验探究Fe3+的氧化性:向FeCl3溶液中通入一定量的SO2气体,溶液由黄色变为浅绿色.
①浅绿色溶液中一定存在的离子有H+、Cl-和 ,可能存在的微粒有 (填写序号).
A.Fe3+ B.Fe2+C.SO42- D.H2SO3
②为确认可能存在的微粒,应选择的试剂是 (填写序号).
A.稀硫酸 B.NaOH溶液 C.KSCN溶液 D.品红溶液.
(1)查阅资料FeSO4高温分解,反应方程式为:2FeSO4
| ||
①用双线桥标出高温分解FeSO4制备Fe2O3反应中电子转移的方向和数目
②为收集SO3并验证SO2,应将气体依次通过浸没在
(2)实验探究Fe3+的氧化性:向FeCl3溶液中通入一定量的SO2气体,溶液由黄色变为浅绿色.
①浅绿色溶液中一定存在的离子有H+、Cl-和
A.Fe3+ B.Fe2+C.SO42- D.H2SO3
②为确认可能存在的微粒,应选择的试剂是
A.稀硫酸 B.NaOH溶液 C.KSCN溶液 D.品红溶液.
考点:铁及其化合物的性质实验,氧化还原反应
专题:实验设计题
分析:(1)①FeSO4高温分解电子转移的方向和数目;
②FeSO4分解产物为:SO3和SO2,要收集SO3,根据SO3溶沸点知:高常温下为液体,采用冰水冷却即可得到SO3固体,剩余气体为SO2气体,检验SO2一般用品红试剂;
(2)溶液中离子的存在,Fe3+与SO2气体反应生成Fe2+和SO42-,2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,故溶液中一定含有:Fe2+、SO42-、H+和不参与反应的Cl-,还可能有反应剩余的SO2与水反应生成的H2SO3,也可能有少量为未反应完的Fe3+,检验这两种微粒分别用品红溶液和KSCN溶液.
②FeSO4分解产物为:SO3和SO2,要收集SO3,根据SO3溶沸点知:高常温下为液体,采用冰水冷却即可得到SO3固体,剩余气体为SO2气体,检验SO2一般用品红试剂;
(2)溶液中离子的存在,Fe3+与SO2气体反应生成Fe2+和SO42-,2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,故溶液中一定含有:Fe2+、SO42-、H+和不参与反应的Cl-,还可能有反应剩余的SO2与水反应生成的H2SO3,也可能有少量为未反应完的Fe3+,检验这两种微粒分别用品红溶液和KSCN溶液.
解答:
解:(1)FeSO4高温分解,反应方程式为:2FeSO4
Fe2O3+SO2↑+SO3↑,FeSO4中,S为+6价,化合价变化为+6→+4,铁的化合价由+2→+3,电子转移的方向和数目为: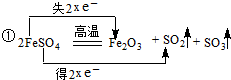 ;
;
故答案为: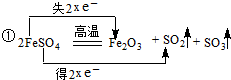 ;
;
②2FeSO4
Fe2O3+SO2↑+SO3↑,FeSO4高温分解气体为SO2和SO3,收集SO3,根据SO3溶沸点知:高常温下为液体,采用冰水冷却即可得到SO3固体,剩余气体为SO2气体,检验SO2一般用品红试剂;
故答案为:冰水混合物、品红溶液或其他正确答案;
(2)溶液由黄色变为浅绿色,说明Fe3+与SO2气体反应生成Fe2+和SO42-,2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,故溶液中一定含有:Fe2+、SO42-、H+和不参与反应的Cl-,还可能有反应剩余的SO2与水反应生成H2SO3,也可能有少量为未反应完的Fe3+,检验这两种微粒分别用品红溶液和KSCN溶液;
故答案为:①BC,AD;②CD.
| ||
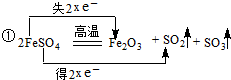 ;
;故答案为:
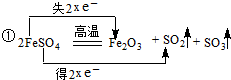 ;
;②2FeSO4
| ||
故答案为:冰水混合物、品红溶液或其他正确答案;
(2)溶液由黄色变为浅绿色,说明Fe3+与SO2气体反应生成Fe2+和SO42-,2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,故溶液中一定含有:Fe2+、SO42-、H+和不参与反应的Cl-,还可能有反应剩余的SO2与水反应生成H2SO3,也可能有少量为未反应完的Fe3+,检验这两种微粒分别用品红溶液和KSCN溶液;
故答案为:①BC,AD;②CD.
点评:本题考查了物质性质实验方案的设计,题目难度中等,试题涉及氧化还原方程式书写、氧化性还原、物质的分离、提纯、检验等知识,明确掌握二氧化硫的性质等知识为解答本题关键.

练习册系列答案
相关题目
科学家最近发现两种粒子:第一种是只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第二种是由四个氧原子构成的分子.下列有关这两种粒子的说法不正确的是( )
| A、“四中子”不显电性 |
| B、第二种粒子是氧元素的另一种同位素 |
| C、“四中子”的质量与一个4He原子质量近似相等 |
| D、第二种粒子的化学式为O4,与O2互为同素异形体 |
下列各种方法中,可制得相应金属的为( )
| A、加热氧化镁 |
| B、电解饱和氯化钠溶液 |
| C、电解熔融氯化钠 |
| D、氯化钠与铝粉高温共热 |
下面是天津大学化工学院研制的2,6-二氯苯胺的合成路线:下列说法正确的是( )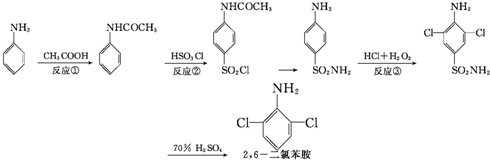

| A、反应①属于取代反应,反应②属于加成反应 |
| B、反应①属于取代反应,反应③属于氧化反应 |
| C、反应①属于取代反应,反应③属于取代反应 |
| D、反应②属于取代反应,反应③属于加成反应 |
 用电化学原理研究金属铝具有重要的意义.
用电化学原理研究金属铝具有重要的意义.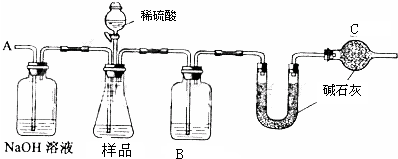
 实验探究:甲、乙同学探究KI固体在空气中放置变质的原因.
实验探究:甲、乙同学探究KI固体在空气中放置变质的原因.
