题目内容
10.对于可逆反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )| A. | 达到化学平衡时,5v正(O2)=4v逆(NO) | |
| B. | 若单位时间内生成x mol NO,同时消耗x mol NH3,则可确定反应达到平衡状态 | |
| C. | 达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率也减小 | |
| D. | 化学反应速率的关系是2v正(NH3)=3v正(H2O) |
分析 当达到化学平衡时,正逆反应速率相等,各物质的浓度、百分含量不变,增大容器的气体,浓度减小,正逆反应速率都减小,以此解答该题.
解答 解:A.反应达到平衡状态时,正逆反应速率相等,4V正(O2)=5V逆(NO),说明消耗氧气的速率和生成氧气的速率相等,故A错误;
B.无论是否达到平衡状态,反应速率之比都等于化学计量数之比,即位时间内生成xmolNO的同时,消耗xmolNH3,但不能说明正逆反应速率相等,故B错误;
C.增大容器的体积,浓度减小,则正反应速率减小,逆反应速率也减小,故C正确;
D.反应速率之比等于化学计量数之比,则3V正(NH3)=2V正(H2O),故D错误.
故选C.
点评 本题综合考查化学平衡的影响因素以及化学平衡状态的判断,为高频考点,题目难度中等,注意用不同物质的表示的正逆反应速率相等的表达方法,此为易错点.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
1.下列叙述正确的是(NA为阿伏加德罗常数的值)( )
| A. | 7.8gNa2O2含有的共价键数为0.2NA | |
| B. | 7.8gNa2S与Na2O2的混合物,含离子总数为0.3NA | |
| C. | 标准状况下,22.4L溴单质含有NA个溴分子 | |
| D. | 0.2 molNa被完全氧化生成7.8gNa2O2,转移电子的数目为0.4NA |
18.已知反应①101kPa时,2C(s)+O2(g)═2CO(g)△H=-221kJ/mol ②稀溶液中,H+(aq)+OHˉ(aq)═H2O(l);△H=-57.3kJ/mol下列结论正确的是( )
| A. | 碳的燃烧热大于110.5 kJ/mol | |
| B. | ①反应的焓变为-221 kJ/mol | |
| C. | 稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
5.某溶液中大量存在五种离子:NO3-、SO42-、Fe3+、H+、X,其中物质的量之比为n(NO3-):n(SO42-):n(Fe3+):( H+):n(X)=2:3:1:3:1则X可能是( )
| A. | Al3+ | B. | Ba2+ | C. | Cl- | D. | Mg2+ |
12.根据题目要求,回答下列问题:
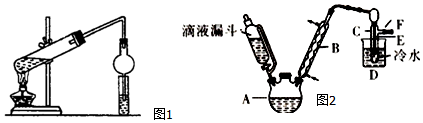
Ⅰ.某同学用乙醇、乙酸和浓硫酸制取乙酸乙酯,装置如图1所示.
(1)装置中干燥管的作用是防止小试管中液体发生倒吸
(2)小试管中的试剂加入顺序为B
A.浓硫酸 乙醇 乙酸 B.乙醇 浓硫酸 乙酸 C.乙酸 浓硫酸 乙醇
II.已知:R-OH+HX→R-X+H2O如图2是实验室用乙醇与浓硫酸和溴化钠反应制备溴乙烷的装置,图中省去了加热装置.乙醇、溴乙烷、溴有关参数数据见表:
(3)本实验中应采取的加热方式是水浴加热.
(4)为除去产品中的Br2,最好选择下列溶液来洗涤产品B.
A.氢氧化钠 B.亚硫酸钠 C.碘化钠
Ⅰ.某同学用乙醇、乙酸和浓硫酸制取乙酸乙酯,装置如图1所示.
(1)装置中干燥管的作用是防止小试管中液体发生倒吸
(2)小试管中的试剂加入顺序为B
A.浓硫酸 乙醇 乙酸 B.乙醇 浓硫酸 乙酸 C.乙酸 浓硫酸 乙醇
II.已知:R-OH+HX→R-X+H2O如图2是实验室用乙醇与浓硫酸和溴化钠反应制备溴乙烷的装置,图中省去了加热装置.乙醇、溴乙烷、溴有关参数数据见表:
| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
(4)为除去产品中的Br2,最好选择下列溶液来洗涤产品B.
A.氢氧化钠 B.亚硫酸钠 C.碘化钠


 可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:
可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空: