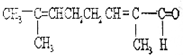题目内容
3.某溶液中加入过量稀H2SO4后,有S和H2SO3生成,则原溶液中可能含有( )| A. | Na2S2O3 | |
| B. | Na2SO3和Na2S且物质的量比值小于$\frac{1}{2}$ | |
| C. | Na2SO3和Na2S且物质的量比值大于$\frac{1}{2}$ | |
| D. | Na2S2O3和Na2S且物质的量比值小于$\frac{1}{2}$ |
分析 溶液中加入过量稀H2SO4后,有S和H2SO3生成,可能为Na2S2O3,加入硫酸发生H2SO4+Na2S2O3=Na2SO4+S+H2SO3,也可能为Na2SO3和Na2S,加入硫酸分别发生Na2S+H2SO4=Na2SO4+H2S、H2SO4+Na2SO3=Na2SO4+H2SO3、2H2S+H2SO3=3S+3H2O,以此解答该题.
解答 解:溶液中加入过量稀H2SO4后,有S和H2SO3生成,可能为Na2S2O3,加入硫酸发生H2SO4+Na2S2O3=Na2SO4+S+H2SO3,
也可能为Na2SO3和Na2S,加入硫酸分别发生Na2S+H2SO4=Na2SO4+H2S、H2SO4+Na2SO3=Na2SO4+H2SO3、2H2S+H2SO3=3S+3H2O,
因有S和H2SO3生成,说明Na2SO3过量,
则Na2SO3和Na2S且物质的量比值大于$\frac{1}{2}$,
故选AC.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析、计算能力的考查,注意把握物质的性质以及反应的相关方程式的书写,为解答该题的关键,难度不大.

练习册系列答案
相关题目
11. 物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价螯合剂,也是化学中间体.下列关于物质X的说法正确的是( )
物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价螯合剂,也是化学中间体.下列关于物质X的说法正确的是( )
 物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价螯合剂,也是化学中间体.下列关于物质X的说法正确的是( )
物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价螯合剂,也是化学中间体.下列关于物质X的说法正确的是( )| A. | X分子式为C6H7O7 | |
| B. | 1 mol物质X可以和3 mol氢气发生加成 | |
| C. | X可以发生消去反应、取代反应等 | |
| D. | 1mol X分别与足量的NaHCO3、Na反应得到的气体体积比为3:2 |
19.①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液.相同条件下,有关上述溶液的比较中正确的是( )
| A. | 水电离的c(H+):①=②=③=④ | |
| B. | 将②、③溶液混合后,pH=7,消耗溶液的体积③>② | |
| C. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②=④>① | |
| D. | 向各溶液中加入100mL水后,溶液的pH:③>④>①>② |