题目内容
5.元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )| A. | 主族金属元素和非金属元素在不同化合物中都可能呈不同的化合价 | |
| B. | 同一元素不可能既表现金属性,又表现非金属性 | |
| C. | 除氢外的短周期元素形成最高价化合物时,最外层都达到8电子稳定结构 | |
| D. | 同一主族的元素,化学性质也可能差异很大 |
分析 A.有的元素在化合物中只呈现1种化合价,如Na、K、F等元素;
B.处于金属与非金属交界处的元素通常表现一定的金属性与非金属性;
C.锂离子核外只有2个电子;
D.同一主族元素具有相似性,但有的元素化学性质差别很大,如碱金属元素中H与Na、K之间.
解答 解:A.主族金属元素和非金属元素在不同化合物中可能呈不同的化合价,但是有的元素在化合物中只有1种化合价,如钠、钾、氟等,故A错误;
B.同一元素可能既表现金属性,又表现非金属性,如处于金属与非金属交界处的元素通常表现一定的金属性与非金属性,故B错误;
C.除氢外的短周期元素形成最高价化合物时,最外层不一定都达到8电子稳定结构,如锂离子最外层只有2个电子,故C错误;
D.同一主族的元素具有相似性和递变性,有的元素化学性质也可能差异很大,如碱金属元素中H为非金属元素,而其它为金属,故D正确;
故选D.
点评 本题考查了元素周期表结构及其应用,题目难度不大,明确元素周期律内容为解答关键,注意掌握元素周期表结构及其应用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
13.下列7种有机物:①甲烷 ②苯 ③聚丙烯 ④2-丁炔 ⑤乙烯 ⑥邻二甲苯既能使酸性高锰酸钾褪色,又能与溴水反应褪色的是( )
| A. | ②③④⑤⑥ | B. | ③④⑤ | C. | ④⑤ | D. | ④⑤⑥ |
20.下列说法正确的是( )
| A. | 绿色化学是指利用化学原理对已产生的环境污染进行治理 | |
| B. | 视频《苍穹之下》再次引起公众对“PM2.5”的关注.“PM2.5”是指大气中直径小于或等于2.5×10-6m的细小颗粒物,这些颗粒扩散在空气中形成胶体 | |
| C. | 离子键、共价键和氢键等化学键都可能对物质的熔沸点产生影响 | |
| D. | 高分子膜在分离提纯、物质制备以及能量转化等领域都有广泛应用 |
10.按C、N、O的顺序,下列递变规律不正确的是( )
| A. | 原子半径逐渐减小 | B. | 元素原子得电子能力逐渐增强 | ||
| C. | 气态氢化物稳定性逐渐增强 | D. | 最高化合价逐渐增高 |
15. NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+═Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况.
NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+═Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况.
(1)此消毒液中NaClO可吸收空气中的CO2生成NaHCO3和HClO而变质.写出化学反应方程式:NaClO+CO2+H2O=NaHCO3+HClO.
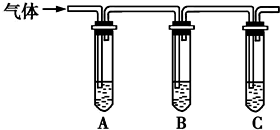
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出.通过如图所示装置检验气体的成分,从而判断该消毒液是否变质.
限选试剂:98%浓硫酸、1%品红溶液、1.0mol•L-1 KI-淀粉溶液、1.0mol•L-1NaOH溶液、澄清石灰水、饱和NaCl溶液.
请完成下列实验方案(如图).
(3)用滴定法测定消毒液中NaClO的浓度.实验步骤如下:
①量取 25.00mL消毒液放入锥形瓶中,加入过量的a mol•L-1 Na2SO3溶液b mL.
②滴定分析.将c mol•L-1的酸性KMnO4溶液装入酸式(填“酸式”或“碱式”)滴定管中滴定,使KMnO4和剩余的Na2SO3发生反应.当溶液由无色变成浅红色,且半分钟内红色保持不褪去时,停止滴定,记录数据.重复滴定实验3次,测得平均消耗酸性KMnO4溶液V mL;滴定过程中涉及的反应有:NaClO+Na2SO3═NaCl+Na2SO4;2KMnO4+5Na2SO3+3H2SO4═K2SO4+2MnSO4+5Na2SO4+3H2O.
③计算.消毒液中NaClO的浓度为$\frac{2ab-5vc}{50}$mol•L-1(用含a、b、c、V的代数式表示).
 NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+═Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况.
NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+═Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况.(1)此消毒液中NaClO可吸收空气中的CO2生成NaHCO3和HClO而变质.写出化学反应方程式:NaClO+CO2+H2O=NaHCO3+HClO.
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出.通过如图所示装置检验气体的成分,从而判断该消毒液是否变质.
限选试剂:98%浓硫酸、1%品红溶液、1.0mol•L-1 KI-淀粉溶液、1.0mol•L-1NaOH溶液、澄清石灰水、饱和NaCl溶液.
请完成下列实验方案(如图).
| 所加试剂 | 预期现象和结论 |
| 向试管A中加足量①1.0mol/LK淀粉溶液; 试管B中加1%品红溶液; 试管C中加②澄清石灰水. | 若A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊,则消毒液部分变质; ③若A中溶液变蓝色,B中溶液不退色(无变化),C中溶液不变浑浊(无变化),则消毒液未变质,则消毒液未变质; ④若A中溶液不变蓝色(无变化),B中溶液不退色(无变化),C中溶液变浑浊则消毒液完全变质,则消毒液完全变质. |
①量取 25.00mL消毒液放入锥形瓶中,加入过量的a mol•L-1 Na2SO3溶液b mL.
②滴定分析.将c mol•L-1的酸性KMnO4溶液装入酸式(填“酸式”或“碱式”)滴定管中滴定,使KMnO4和剩余的Na2SO3发生反应.当溶液由无色变成浅红色,且半分钟内红色保持不褪去时,停止滴定,记录数据.重复滴定实验3次,测得平均消耗酸性KMnO4溶液V mL;滴定过程中涉及的反应有:NaClO+Na2SO3═NaCl+Na2SO4;2KMnO4+5Na2SO3+3H2SO4═K2SO4+2MnSO4+5Na2SO4+3H2O.
③计算.消毒液中NaClO的浓度为$\frac{2ab-5vc}{50}$mol•L-1(用含a、b、c、V的代数式表示).
 已知某烃A的产量是衡量一个国家石油化工水平的标志,能发生下列转化关系(部分反应物或生成物及反应条件已略去):
已知某烃A的产量是衡量一个国家石油化工水平的标志,能发生下列转化关系(部分反应物或生成物及反应条件已略去):