题目内容
写出下列物质在水溶液里的电离方程式:
(1)硝酸 ;(2)氢氧化钾 ;(3)氯化铜 .
(1)硝酸
考点:电离方程式的书写
专题:离子反应专题
分析:(1)硝酸为强电解质,在溶液中完全电离出氢离子和硝酸根离子;
(2)氢氧化钾为强电解质,在溶液中完全电离出钾离子和氢氧根离子;
(3)氯化铜为强电解质,在溶液中电离出氯离子和铜离子.MgCl2=Mg2++Cl2-
(2)氢氧化钾为强电解质,在溶液中完全电离出钾离子和氢氧根离子;
(3)氯化铜为强电解质,在溶液中电离出氯离子和铜离子.MgCl2=Mg2++Cl2-
解答:
解:(1)硝酸在溶液中电离出氢离子和硝酸根离子,其电离方程式为:HNO3=H++NO3-,故答案为:HNO3=H++NO3-;
(2)氢氧化钾为强电解质,在溶液中电离出钾离子和氢氧根离子,其电离方程式为:KOH=K++OH-,故答案为:KOH=K++OH-;
(3)氯化铜为强电解质,在溶液中完全电离,其电离方程式为:CuCl2=Cu2++2Cl-,故答案为:CuCl2=Cu2++2Cl-.
(2)氢氧化钾为强电解质,在溶液中电离出钾离子和氢氧根离子,其电离方程式为:KOH=K++OH-,故答案为:KOH=K++OH-;
(3)氯化铜为强电解质,在溶液中完全电离,其电离方程式为:CuCl2=Cu2++2Cl-,故答案为:CuCl2=Cu2++2Cl-.
点评:本题考查了电离方程式的书写,题目难度不大,注意掌握强电解质与弱电解质的概念及判断方法,明确电离方程式的书写原则是解答本题的关键.

练习册系列答案
相关题目
一定温度下,某一密闭且体积不变的容器内有可逆反应:A(g)+3B(g)?2C(g).该反应进行到一定限度后达到了化学平衡,该化学平衡的标志是( )
| A、C物质的生成速率和分解速率相等 |
| B、容器内气体的密度不再随时间而改变 |
| C、单位时间内生成amol物质A,同时生成3amol物质B |
| D、A、B、C的浓度相等 |
一元酯A在酸性条件下水解得到一元饱和羧酸M与醇N(分子式为C5H12O),且醇N在一定条件下可氧化为M.则此酯A最多有几种结构( )
| A、4种 | B、3种 |
| C、16种 | D、32种 |
 Ⅰ、可用于物质的分离与提纯的常用方法主要有:A.蒸馏B.过滤C.结晶D.升华E.萃取,分液.下列各组混合物的分离或提纯应选用上述哪种方法最合适?(填序号)
Ⅰ、可用于物质的分离与提纯的常用方法主要有:A.蒸馏B.过滤C.结晶D.升华E.萃取,分液.下列各组混合物的分离或提纯应选用上述哪种方法最合适?(填序号)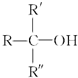 不能被氧化剂氧化(R,R′,R″均表示烃基),根据上述反应机理回答下列问题:
不能被氧化剂氧化(R,R′,R″均表示烃基),根据上述反应机理回答下列问题: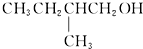 在有Cu和加热条件下与O2反应的化学方程式
在有Cu和加热条件下与O2反应的化学方程式