题目内容
已知A、B、C、D、E、F六种短周期元素中,A、B、C、D是组成蛋白质的基本元素;A与B的原子序数之和等于C原子核内的质子数;A与E、D与F分别位于同一主族,且F原子核内的质子数是D原子核外电子数的2倍。据此,请回答:
(1)F在周期表中的位置是 。
(2)由A、C、D、F按8:2:4:1原子个数比组成的化合物甲中含有的化学键类型为 ;甲溶液中各离子浓度由大到小的顺序为 (用离子浓度符号表示)。
(3)化合物乙由A、C组成且相对分子质量为32;化合物丙由A、D组成且分子内电子总数与乙分子内电子总数相等;乙与丙的反应可用于火箭发射(反应产物不污染大气),则该反应的化学方程式为 。
(4)由A、D、E、F组成的化合物丁能与硫酸反应并放出刺激性气味的气体,则丁的化学式为 ;实验测得丁溶液显弱酸性,由此你能得出的结论是 。
(5)由B、A按1:4原子个数比组成的化合物戊与D的常见气态单质及NaOH溶液构成原电池(如图),试分析: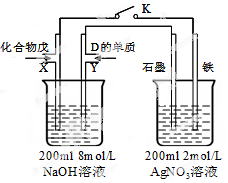
①闭合K,写出左池X电极的反应式 ;
②闭合K,当X电极消耗1.6g化合物戊时(假设过程中无任何损失),则右池两极共放出气体在标准状况下的体积为 升。
(1)第3周期VIA族;
(2)离子键、共价键;c(NH4+)>c(SO42-)>c(H+)>c(OH-)
(3)N2H4+2H2O2=N2+4H2O
(4)NaHSO3;HSO3-的电离程度大于其水解程度
(5)①CH4-8e-+10OH-=CO32-+7H2O ②4.48
解析本题先推断出元素。要学会用笔圈“圈”,如“短周期”、“蛋白质基本元素”(H、C、O、N)“质子数:A+B=C”、“A与E、D与F,是主族”、“质子数:F=2D”,很自然,由圈出“圈”就很方便的推断各个元素。由题中不能难看出,
A-H、B-C、C-N、D-O、E-Na、F-S。
(1)第(1)问注意族规范化表示;
(2)H、N、O、S四种元素组成的化合物不外乎是,NH4HSO4,(NH4)SO4、且要符合“8:2:4:1”,所以不会是亚硫酸盐。该化合物是(NH4)SO4。由于NH4+水解显酸性,因而有含有化学键是离子键和共价键,离子浓度大小顺序为,c(NH4+)>c(SO42-)>c(H+)>c(OH-)
(3)由题意知,两个化合物是电子数相等的分子,必然是N2H4,H2O2,其发生反应的方程式为,N2H4+2H2O2=N2+4H2O。
(4)H、O、Na、S组成的化合物能与硫酸反应产生刺激性气体,根据强酸制弱酸的道理,该盐酸是亚硫酸氢钠,“酸性”,说明HSO3-电离程度大于水解程度。
(5)第(5)问是CH4、O2、电解质溶液NaOH溶液组成的燃料电池,甲烷在负极通入,氧气在正极通入,电极反应式是CH4-8e-+10OH-=CO32-+7H2O,由电极式中电子守恒不难求出两极共放出的气体。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案下列实验“操作和现象”与“结论”对应关系正确的是
| | 操作和现象 | 结论 |
| A | 向NaCl溶液先滴加少量AgNO3溶液,后滴加少量NaI溶液,先有白色沉淀,后变成黄色沉淀 | 说明Ksp(AgI)<Ksp(AgCl) |
| B | 将SO2通人品红溶液中,红色褪去 | 说明SO2具有漂白性 |
| C | 向FeCl3、CuCl2混合溶液加铁粉,有红色固体析出 | 说明氧化性:Cu2+>Fe3+ |
| D | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有Ag+ |
下列说法正确的是
| A.SiO2可溶于强碱溶液,不溶于任何酸 |
| B.当光束通过淀粉溶液时,无法观察到丁达尔现象 |
| C.铝热反应可用于焊接钢轨和金属的冶炼 |
| D.漂白粉的有效成分是有强氧化性的氯化钙和次氯酸钙 |
将溶液(或气体)X,逐渐加入(或通入)到一定量的Y溶液中,产生沉淀的量与加入X物质的量的关系如下图,符合图中情况的一组物质是( )。
| | A | B | C | D |
| X | H2S | HCl | NH3 | NH3·H2O |
| Y | Na2SO3 | NaAlO2 | AlCl3 | AgNO3 |
下列化学实验事实及其结论都正确的是( )
| 选项 | 实验事实 | 结论 |
| A | 将SO2通入含HClO的溶液中生成H2SO4 | HClO的酸性比H2SO4强 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | SiO2可以和NaOH溶液及HF溶液反应 | SiO2属于两性氧化物 |
| D | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |