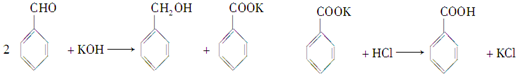
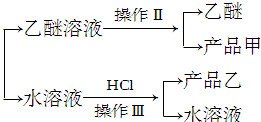
题目内容
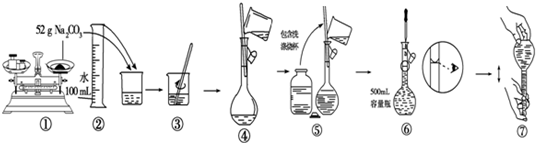
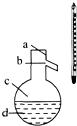
9.图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
(1)装置图1中A的名称是蒸馏.A 中加入碎瓷片的作用是防止暴沸.
(2)为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

①灼烧海带时,除需要酒精灯与三脚架外,还需要用到的实验仪器是BD(从下列仪器中选出所需仪器,用标号字母填写在空白处);
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.铁架台 F.干燥器
②步骤③的实验选择上述装置图3 (填图的序号).步骤⑤的实验操作名称是萃取.步骤⑥的目的是从含碘苯溶液中分离出单质碘,同时回收苯,该步骤的实验操作名称是蒸馏,选择上述装置图1(填图的序号)
分析 (1)装置1为蒸馏操作,加入碎瓷片,可防止暴沸;
(2)海带灼烧后得到海带灰浸泡后得到海带灰的浊液,过滤得到含碘离子的溶液加入二氧化锰和稀硫酸氧化碘离子为碘单质,得到含碘水溶液,加入有机溶剂苯,萃取分液得到含碘的苯溶液,通过蒸馏得到碘单质.
解答 解:(1)装置1为蒸馏操作,沸石或碎瓷片可防止暴沸,故答案为:蒸馏;防止暴沸;
(2)海带灼烧后得到海带灰浸泡后得到海带灰的浊液,过滤得到含碘离子的溶液加入二氧化锰和稀硫酸氧化碘离子为碘单质,得到含碘水溶液,加入有机溶剂苯,萃取分液得到含碘的苯溶液,通过蒸馏得到碘单质,
①灼烧海带需要加热装置,所以步骤①灼烧海带时,除需要酒精灯与三脚架外,还需要用到的实验仪器是泥三角、坩埚,故答案为:BD;
②步骤③用于得到溶液,应除去固体杂质,为过滤操作,步骤⑤得到含碘苯溶液,为萃取操作,步骤⑥的目的是从含碘苯溶液中分离出单质碘,同时回收苯,应为蒸馏操作,
故答案为:3;萃取;蒸馏;1.
点评 本题考查海水资源的综合利用,侧重考查物质的检验、混合物的分离和提纯,明确常见混合物分离和提纯方法及其选取方法是解本题关键,常见的分离方法有:过滤、蒸馏、渗析、加热等..

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
19. 1994年伟大的化学家鲍林(Linus Pauling)教授谢世时,留给后人很多谜团,其中一个结构式如图所示.老人为什么画这个结构式?它是 生命的前物质?它能合成吗?它有什么性质?不得而知.也许这是永远无法解开的谜;也许你有朝一日能解开它.某同学对此结构及性质有如下的推测,你认为不正确的是( )
1994年伟大的化学家鲍林(Linus Pauling)教授谢世时,留给后人很多谜团,其中一个结构式如图所示.老人为什么画这个结构式?它是 生命的前物质?它能合成吗?它有什么性质?不得而知.也许这是永远无法解开的谜;也许你有朝一日能解开它.某同学对此结构及性质有如下的推测,你认为不正确的是( )
 1994年伟大的化学家鲍林(Linus Pauling)教授谢世时,留给后人很多谜团,其中一个结构式如图所示.老人为什么画这个结构式?它是 生命的前物质?它能合成吗?它有什么性质?不得而知.也许这是永远无法解开的谜;也许你有朝一日能解开它.某同学对此结构及性质有如下的推测,你认为不正确的是( )
1994年伟大的化学家鲍林(Linus Pauling)教授谢世时,留给后人很多谜团,其中一个结构式如图所示.老人为什么画这个结构式?它是 生命的前物质?它能合成吗?它有什么性质?不得而知.也许这是永远无法解开的谜;也许你有朝一日能解开它.某同学对此结构及性质有如下的推测,你认为不正确的是( )| A. | 它的分子式是C6N10H2O2 | |
| B. | 该物质最多可以有18个原子处于同一个平面上 | |
| C. | 它可以与别的物质发生加成反应 | |
| D. | 因其含氮量高,有可能作炸药 |
17.下列不能与水反应的是( )
| A. | Fe | B. | Fe3O4 | C. | Na | D. | Na2O |
4.欲除去CuSO4•5H2O中的沙子,必要的实验操作为( )
| A. | 溶解 过滤 蒸发结晶 | B. | 加热 溶解 过滤 | ||
| C. | 溶解 过滤 蒸馏 | D. | 溶解 过滤 分液 |
1.短周期元素W、X、Y、Z在元素周期表中的位置如表所示.其中Z的单质是一种重要的半导体材料,广泛应用于电子工业的各个领域.
(1)W在元素周期表中的位置是第二周期第ⅣA族.
(2)r(Yn+)<r(Xm-).(填“>”“﹦”“<”)
(3)下列选项中,能证明元素非金属性X强于W的是CD.
A.原子序数:X>W B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W D.最高价氧化物的水化物酸性:X>W
(4)元素周期表中与Z同周期的某金属元素形成的单质A,可发生如图所示的转化:

其中化合物D是一种白色沉淀,则A生成B的化学方程式为2Na+2NaOH+2H2O=2NaAlO2+3H2↑;B与C混合反应的离子方程式为Al3++3 AlO2-+6H2O=4Al(OH)3↓.
| W | X | ||
| Y | Z |
(2)r(Yn+)<r(Xm-).(填“>”“﹦”“<”)
(3)下列选项中,能证明元素非金属性X强于W的是CD.
A.原子序数:X>W B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W D.最高价氧化物的水化物酸性:X>W
(4)元素周期表中与Z同周期的某金属元素形成的单质A,可发生如图所示的转化:

其中化合物D是一种白色沉淀,则A生成B的化学方程式为2Na+2NaOH+2H2O=2NaAlO2+3H2↑;B与C混合反应的离子方程式为Al3++3 AlO2-+6H2O=4Al(OH)3↓.
19.下列关于乙烯和聚乙烯的叙述中正确的是( )
| A. | 二者互为同系物 | |
| B. | 聚乙烯是乙烯的缩聚产物 | |
| C. | 二者都能使溴的四氯化碳溶液褪色 | |
| D. | 等质量的乙烯和聚乙烯分别完全燃烧消耗等物质的量的氧气,生成等量的水 |
 实验室制备苯甲醇和苯甲酸的化学原理是
实验室制备苯甲醇和苯甲酸的化学原理是