题目内容
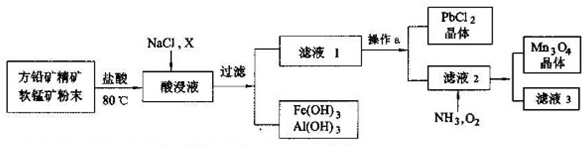
7.三聚磷酸钠(Na5P3O10)是一种优良的洗涤剂添加剂.工业制备流程如下: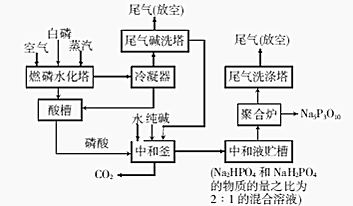
(1)燃磷时,必须通入足量的空气,其目的是使白磷充分氧化,燃烧水化塔中发生反应的化学方程式为P4+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5,P2O5+3H2O=2H3PO4.
(2)中和釜中发生反应的离子方程式为6H3PO4+5CO32-=4HPO42-+2H2PO4-+5CO2↑+5H2O.高温下在聚合炉中发生反应的化学方程式为2Na2HPO4+NaH2PO4=Na5P3O10+2H2O.
(3)该生产工艺对含磷废液及废气经处理后再排放,其目的是防止磷资源流失及防止含磷废水引发水体富营养化.根据流程图,如何利用中和釜中排放出CO2?通入“尾气碱洗塔”吸收生成碳酸钠,从而循环使用
(4)测定某洗涤剂中Na5P3O10的含量可用间接滴定法:
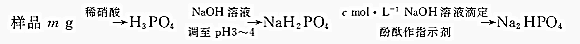
若滴定至终点时,消耗标准溶液VmL,则质量分数w(Na5P3O10)=$\frac{368cV}{30m}%$(用含m、c、V的代数式表示).
分析 白磷、空气、水蒸气进入燃磷水化塔发生反应生成磷酸进入酸槽,冷凝器中冷凝得到酸进入酸槽,尾气进入尾气碱洗塔吸收酸性气体二氧化碳生成碳酸钠循环使用,剩余尾气放空,得到磷酸进入中和釜加入纯碱和水发生反应生成磷酸二氢钠和磷酸氢二钠的混合溶液进入聚合炉得到Na5P3O10,尾气洗涤塔气进入尾气洗涤塔后放空,
(1)燃磷时,必须通入足量的空气,保证磷燃烧充分生成五氧化二磷,燃磷水化塔中五氧化二磷和水反应生成磷酸;
(2)中和釜中发生反应是磷酸和碳酸钠反应生成磷酸氢二钠和磷酸二氢钠,二者按照2:1生成,同时生成二氧化碳和水,高温下在聚合炉中发生反应是磷酸氢二钠和磷酸二氢钠按照2:1聚合为Na5P3O10;
(3)该生产工艺对含磷废液及废气经处理后再排放是防止磷资源流失污染水体和环境,中和釜中排放出CO2通入“尾气碱洗塔”吸收生成碳酸钠,从而循环使用;
(4)样品溶于硝酸得到磷酸,加入利用氢氧化钠溶液调节溶液PH=3~4得到NaH2PO4,滴入cmol/L的NaOH溶液滴定反应得到Na2HPO4,消耗标准溶液VmL,依据磷元素守恒计算.
解答 解:白磷、空气、水蒸气进入燃磷水化塔发生反应生成磷酸进入酸槽,冷凝器中冷凝得到酸进入酸槽,尾气进入尾气碱洗塔吸收酸性气体二氧化碳生成碳酸钠循环使用,剩余尾气放空,得到磷酸进入中和釜加入纯碱和水发生反应生成磷酸二氢钠和磷酸氢二钠的混合溶液进入聚合炉得到Na5P3O10,尾气洗涤塔气进入尾气洗涤塔后放空,
(1)燃磷时,必须通入足量的空气,保证磷燃烧充分生成五氧化二磷,燃磷水化塔中五氧化二磷和水反应生成磷酸,反应的化学方程式为:P4+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5,P2O5+3H2O=2H3PO4,
故答案为:使白磷充分氧化;P4+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5,P2O5+3H2O=2H3PO4;
(2)中和釜中发生反应是磷酸和碳酸钠反应生成磷酸氢二钠和磷酸二氢钠,二者按照2:1生成,同时生成二氧化碳和水,反应的化学方程式为:6H3PO4+5CO32-=4HPO42-+2H2PO4-+5CO2↑+5H2O,高温下在聚合炉中发生反应是磷酸氢二钠和磷酸二氢钠按照2:1聚合为Na5P3O10,反应的化学方程式为:2Na2HPO4+NaH2PO4=Na5P3O10+2H2O,
故答案为:6H3PO4+5CO32-=4HPO42-+2H2PO4-+5CO2↑+5H2O;2Na2HPO4+NaH2PO4=Na5P3O10+2H2O;
(3)该生产工艺对含磷废液及废气经处理后再排放是防止磷资源流失污染水体和环境,含磷废水引发水体富营养化,中和釜中排放出CO2通入“尾气碱洗塔”吸收生成碳酸钠,从而循环使用,该生产工艺对含磷废液及废气经处理后再排放,其目的是防止磷资源流失及防止含磷废水引发水体富营养化,排放出CO2通入“尾气碱洗塔”吸收生成碳酸钠,从而循环使用,
故答案为:防止磷资源流失及防止含磷废水引发水体富营养化;通入“尾气碱洗塔”吸收生成碳酸钠,从而循环使用;
(4)样品溶于硝酸得到磷酸,加入利用氢氧化钠溶液调节溶液PH=3~4得到NaH2PO4,滴入cmol/L的NaOH溶液滴定反应得到Na2HPO4,消耗标准溶液VmL,依据磷元素守恒计算,Na5P3O10=~3H3PO4~3NaH2PO4~3Na2HPO4~3NaOH
1 3
n cmol/L×V×10-3L
n=$\frac{cV×1{0}^{-3}}{3}$mol
则质量分数w(Na5P3O10)=$\frac{\frac{cV×1{0}^{-3}}{3}×368g/mol}{mg}$×100%=$\frac{368cV}{30m}%$,
故答案为:$\frac{368cV}{30m}%$.
点评 本题考查了物质制备的方案分析,生产流程的理解应用,主要是题干信息的理解分析,化学方程式书写和含量计算是解题关键,题目难度中等.

| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 112.4 (100℃左右升华) | 248 | 1.2659 | 微溶 | 易溶 |
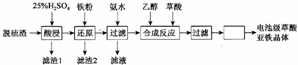
按下列合成步骤回答问题:
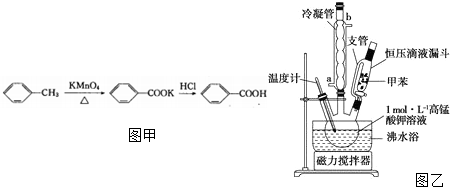
Ⅰ.苯甲酸制备:(1)按如图乙所示以三颈烧瓶为反应器,用30.0mL甲苯和25.0mL 1mol•L-1高锰酸钾溶液在80℃下反应30min,静置发现不再出现分层现象时,停止反应.装置中a是将甲苯和水冷凝回流,防止甲苯的挥发而降低产品产率.(填进水管或出水管)图中支管的作用是平衡压强,便于甲苯顺利滴入三颈烧瓶.
Ⅱ.分离提纯.
(2)在反应后的混合物中加入一定量亚硫酸氢钠溶液充分反应使紫色褪去,此时反应的离子方程式为2MnO4-+3HSO3-+OH-=2MnO2↓+3SO42-+2H2O.
(3)过滤、洗涤,将滤液放在冰水浴中冷却,然后用浓盐酸酸化,苯甲酸全部析出后减压过滤,将沉淀物用少量冷水洗涤,除杂.产品减压过滤时用冷水洗涤的原因是苯甲酸在冷水中的溶解度较小,用冷水洗涤可以减少产品的损失,把制得的苯甲酸粗产品进一步提纯,可用下列D操作(填字母)
A.溶于水后过滤 B.溶于乙醇后蒸馏C.用甲苯萃取后分液 D.升华.
Ⅲ.产品纯度测定.
(4)称取1.220g产品,配成100mL乙醇溶于,移取25.00mL溶于于锥形瓶中,滴加2-3滴酚酞(填写“甲基橙”或“酚酞”),然后用0.1000mol•L-1KOH溶液滴定,滴定终点溶液的颜色变化是溶液颜色由无色变为浅红色,且30S内不褪色.到达滴定终点时消耗KOH溶液24.00mL(苯甲酸的相对分子质量:122).产品中苯甲酸质量分数为96.00%.
完成下列填空:
(1)用NaOH固体配制30%的NaOH溶液,所需的玻璃仪器除烧杯外,还有b.
a容量瓶 b量筒 c.烧瓶
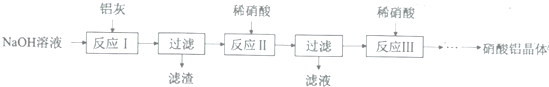
(2)反应Ⅱ中为避免铝的损失,需要解决的问题是如何控制反应终点(或硝酸的用量).
(3)从反应Ⅲ所得溶液中得到硝酸铝晶体的步骤依次是:减压蒸发、冷却结晶、过滤、洗涤、低温烘干.
(4)有人建议将反应Ⅱ、Ⅲ合并以简化操作,说明工业上不采用这种方法的原因产物中杂质NaNO3的含量较高.
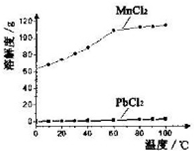
(5)某同学在实验室用铝灰制各硝酸铝晶体,其流程如下:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 4.2 |
| 沉淀完全pH | 3.2 | 5.4 |
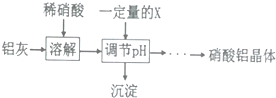
调节pH的目的是将Fe3+转化为Fe(OH)3沉淀除去.为使得到的硝酸铝晶体较纯净,所用的X物质可以是BC(填编号).
A.氨水 B.铝 c.氢氧化铝 D.偏铝酸钠
(6)该实验室制法与工业上制法相比,其缺点是产生大量污染性气体NO等.
(7)称取7.392g硝酸铝晶体样品,加热灼烧使其分解完全,最终得到1.020gAl2O3,计算硝酸铝晶体样品中结晶水的数目为8.7.
 互为同分异构体,G的苯环上的一氯代物只有一种结构,则G可能的结构有( )
互为同分异构体,G的苯环上的一氯代物只有一种结构,则G可能的结构有( )| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
| A. | X、Y和 Z的原子半径大小顺序为 Y>Z>X | |
| B. | Z和 Y组成的化合物中一定既有离子键又有共价键. | |
| C. | 元素 X、Y、W各自最高和最低化合价的代数和分别为 0、4、4 | |
| D. | 同时含有 X、Y、Z、W四种元素的两种不同化合物能相互反应 |
| A. | B<A<D<C<E | B. | E<B<A<D<C | C. | B<A<E<D<C | D. | E<D<C<B<A |
| A. | Li是最活泼金属,F是最活泼非金属 | |
| B. | 稀有气体原子的最外层电子数都为8 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 | |
| D. | X2+的核外电子数目为10,则X在第三周期第ⅡA族 |