题目内容
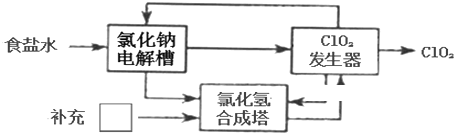
某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理.
(1)请完成实验室制氯气的离子方程式
用上述液体吸收尾气氯气初始阶段的化学反应方程式
(2)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
①提出合理假设:假设1:只存在SO32-; 假设2:既不存在SO32-也不存在ClO-; 假设3: .
②设计实验方案,进行实验.请在答题卡上写出实验步骤以及预期现象和结论.限选实验试剂:3moL?L-1H2SO4、1moL?L-1NaOH、0.01mol?L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
(1)请完成实验室制氯气的离子方程式
用上述液体吸收尾气氯气初始阶段的化学反应方程式
(2)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
①提出合理假设:假设1:只存在SO32-; 假设2:既不存在SO32-也不存在ClO-; 假设3:
②设计实验方案,进行实验.请在答题卡上写出实验步骤以及预期现象和结论.限选实验试剂:3moL?L-1H2SO4、1moL?L-1NaOH、0.01mol?L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
| 实验步骤 | 预期现象和结论 |
步骤1:取少量吸收液于试管中,滴加3moL?L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. | / |
| 步骤2: | |
| 步骤3: |
考点:氯气的实验室制法,氯气的化学性质,二氧化硫的化学性质,物质的检验和鉴别的实验方案设计
专题:实验设计题,元素及其化合物
分析:(1)浓盐酸与二氧化锰在加热条件下反应生成氯化锰、氯气和水;氯气与亚硫酸钠、氢氧化钠反应生成硫酸钠和氯化钠;
(2)①SO32-和ClO-都存在或者只存在ClO-;
②硫酸电离生成氢离子,溶液显酸性,次氯酸具有漂白性;
亚硫酸根离子具有强的还原性,能被酸性的高锰酸钾氧化而使高锰酸钾褪色.
(2)①SO32-和ClO-都存在或者只存在ClO-;
②硫酸电离生成氢离子,溶液显酸性,次氯酸具有漂白性;
亚硫酸根离子具有强的还原性,能被酸性的高锰酸钾氧化而使高锰酸钾褪色.
解答:
解:(1)浓盐酸与二氧化锰反应的离子方程式:4H++MnO2+2Cl-=Mn2++Cl2+H2O;
吸收过少量SO2的NaOH溶液与氯气反应的化学方程式:Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O;
故答案为:4H++MnO2+2Cl-=Mn2++Cl2+H2O;Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O;
(2)①假设3:两种离子都存在(或者 只存在ClO-);
故答案为:两种离子都存在(或者 只存在ClO-);
②硫酸电离生成氢离子,溶液显酸性,能够使紫色的石蕊试液变红色,次氯酸具有漂白性,能够使变红的溶液褪色;
亚硫酸根离子具有强的还原性,能被酸性的高锰酸钾氧化而使高锰酸钾褪色;
故答案为:
吸收过少量SO2的NaOH溶液与氯气反应的化学方程式:Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O;
故答案为:4H++MnO2+2Cl-=Mn2++Cl2+H2O;Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O;
(2)①假设3:两种离子都存在(或者 只存在ClO-);
故答案为:两种离子都存在(或者 只存在ClO-);
②硫酸电离生成氢离子,溶液显酸性,能够使紫色的石蕊试液变红色,次氯酸具有漂白性,能够使变红的溶液褪色;
亚硫酸根离子具有强的还原性,能被酸性的高锰酸钾氧化而使高锰酸钾褪色;
故答案为:
| 步骤2:在A试管中滴加紫色石蕊试液 | 若先变红后退色,证明有ClO-,否则无 |
| 步骤3:在B试管中滴加0.01mol?L-1KMnO4溶液 | 若紫红色退去,证明有SO32-,否则无 |
点评:本题为实验题,明确物质的性质是解题关键,(2)题为难点,注意依据反应产物的性质设计实验,题目难度中等.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目
下列说法中不正确的是( )
| A、按系统命名法:CH3CH2C(CH3)2CH(C2H5)CH3的正确名称是3,3,4-三甲基己烷 |
| B、所有的糖、油脂、蛋白质都能水解,但水解产物不同 |
C、1mol的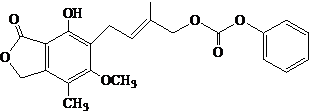 最多能与含5mol NaOH的水溶液完全反应 最多能与含5mol NaOH的水溶液完全反应 |
D、若完全燃烧,1mol雄酮( 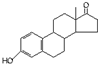 )比雌酮( )比雌酮(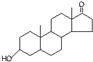 )多消耗3mol O2. )多消耗3mol O2. |
上世纪80年代后期,人们发现NO在人体内起着多方面重要的生理作用.下列关于NO的说法错误的是( )
| A、NO是汽车尾气的有害成分之一 |
| B、NO是具有刺激性气味的红棕色气体 |
| C、NO极少量时在人体的血管系统内会促进血管扩张,防止血管栓塞 |
| D、NO能够与人体血红蛋白结合,吸入较多会造成人体缺氧中毒 |

 【化学-选修3:物质结构与性质】
【化学-选修3:物质结构与性质】