题目内容
 X是一种重要的工业原料,X在160℃分解制备异氰酸和氨气,反应方程式为:X
X是一种重要的工业原料,X在160℃分解制备异氰酸和氨气,反应方程式为:X| 160℃ |
(1)在上述反应所涉及的各元素中,原子半径最大的元素是
(2)在上述物质中有三种元素处于同周期,下列叙述中能说明三种元素非金属性递变规律的事实是
a.最高价氧化物对应水化物的酸性
b.单质与H2反应的难易程度
c.两两形成化合物中元素的化合价
(3)工业上在催化剂条件下,用NH3作为还原剂将烟气中的NOx还原成无害的氮和水,反应方程式可表示为:2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O(g),一定条件下该反应在容积为2L的容器内反应,20min时达到平衡,生成N20.4mol,则平均反应速率υ(NO)=
(4)当该反应达到平衡时,下列说法一定错误的是
a.气体密度不变 b.气体颜色不变
c.υ(NO)正=2υ(N2)逆 d.N2和NH3的浓度相等
(5)X可以代替NH3还原烟气中的NOx,X的分子模型如图所示,X电子式为
(6)氰酸有两种结构,一种分子内含有叁键,称为氰酸,另一种分子内不含叁键,称为异氰酸,且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构.请分别写出氰酸和异氰酸的结构式:
考点:非金属在元素周期表中的位置及其性质递变的规律,微粒半径大小的比较,化学平衡状态的判断
专题:元素周期律与元素周期表专题,化学平衡专题
分析:(1)C、O、N元素位于周期表相同周期,原子序数越大,半径越小;结合核外电子排布判断轨道数目;
(2)a.O元素无正价;
b.氨气键能较大,难以与氢气反应;
c.根据元素的化合价,可知反应中得失电子的难易;
(3)根据v=
计算;
(4)达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量不变,以此判断是否达到平衡状态;
(5)由模型可知分子式为CO(NH2)2,由此可确定电子式;
(6)根据共价键的特点和原子核外电子排布确定结构简式.
(2)a.O元素无正价;
b.氨气键能较大,难以与氢气反应;
c.根据元素的化合价,可知反应中得失电子的难易;
(3)根据v=
| △c |
| △t |
(4)达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量不变,以此判断是否达到平衡状态;
(5)由模型可知分子式为CO(NH2)2,由此可确定电子式;
(6)根据共价键的特点和原子核外电子排布确定结构简式.
解答:
解:(1)C、O、N元素位于周期表相同周期,原子序数越大,半径越小,则原子半径最大的为C,C原子的核外电子排布为1s22s22p2,原子核外电子分别占据1s、2s、2个2p轨道,共4个,
故答案为:C;4;
(2)a.O元素无正价,故a错误;
b.氨气键能较大,难以与氢气反应,不能用于比较非金属性强弱,故b错误;
c.形成的化合物分别为N4C3、NO、CO,由化合价可知在反应中得失电子的难易,可知非金属性O>N>C,故c正确.
故答案为:c;
(3)υ(NO)=
v(N2)=
×
=0.005mol/(L?min),故答案为:0.005;
(4)a.因容器的体积比变,气体的质量不变,气体密度不变不能作为判断是否平衡的依据,但平衡时密度一定不变,故a不选;
b.气体颜色不变,说明浓度不变,可说明达到平衡状态,故b不选;
c.υ(NO)正=2υ(N2)逆,正逆反应速率不等,不能达到平衡状态,故c选;
d.N2和NH3的浓度相等,一般不能作为判断的依据,如反应的起始配比数和转化率在一定数值时,达到平衡时,二者可能相同,故d不选,
故答案为:c;
(5)由模型可知分子式为CO(NH2)2,电子式为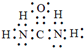 ,故答案为:
,故答案为: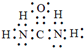 ;
;
(6)氰酸有两种结构,一种分子内含有叁键,称为氰酸,另一种分子内不含叁键,称为异氰酸,且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构,可知氰酸的结构式为H-O-C≡N,异氰酸的结构式为H-N=C=O,
故答案为:H-O-C≡N;H-N=C=O.
故答案为:C;4;
(2)a.O元素无正价,故a错误;
b.氨气键能较大,难以与氢气反应,不能用于比较非金属性强弱,故b错误;
c.形成的化合物分别为N4C3、NO、CO,由化合价可知在反应中得失电子的难易,可知非金属性O>N>C,故c正确.
故答案为:c;
(3)υ(NO)=
| 1 |
| 2 |
| ||
| 20min |
| 1 |
| 2 |
(4)a.因容器的体积比变,气体的质量不变,气体密度不变不能作为判断是否平衡的依据,但平衡时密度一定不变,故a不选;
b.气体颜色不变,说明浓度不变,可说明达到平衡状态,故b不选;
c.υ(NO)正=2υ(N2)逆,正逆反应速率不等,不能达到平衡状态,故c选;
d.N2和NH3的浓度相等,一般不能作为判断的依据,如反应的起始配比数和转化率在一定数值时,达到平衡时,二者可能相同,故d不选,
故答案为:c;
(5)由模型可知分子式为CO(NH2)2,电子式为
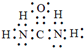 ,故答案为:
,故答案为: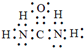 ;
;(6)氰酸有两种结构,一种分子内含有叁键,称为氰酸,另一种分子内不含叁键,称为异氰酸,且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构,可知氰酸的结构式为H-O-C≡N,异氰酸的结构式为H-N=C=O,
故答案为:H-O-C≡N;H-N=C=O.
点评:本题考查较为综合,涉及元素周期律、化学平衡、电子式、结构简式等知识,侧重于学生的分析能力的考查,为高频考点,注意相关基础知识的积累和学习,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
物质的量浓度相同的盐酸和氨水,下列说法中错误的是( )
| A、若混合后溶液呈中性,则有c(Cl-)=c(NH4+) |
| B、用湿润的pH试纸测定两溶液的pH时,氨水的误差更小 |
| C、若混合后溶液呈中性,则所需氨水的体积小于盐酸的体积 |
| D、两溶液等体积混合时,充分反应后:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
下列反应的离子方程式书写正确的是( )
| A、少量二氧化碳通入Ba(OH)2溶液中:CO2+OH-=HCO3- |
| B、向Ba(OH)2溶液逐滴加入稀硫酸:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| C、向双氧水中通入SO2:SO2+H2O2=2H++SO42- |
| D、锌与稀硫酸反应:Zn+4H++SO42-=Zn2++SO2↑+2H2O |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、常温常压下,2.24L CO和CO2混合气体中含有的碳原子数目为0.1NA |
| B、100ml 18.4mol/L的浓硫酸与足量铜加热充分反应后生产SO2的数目为0.92NA |
| C、密闭容器中盛有0.1mol N2和0.3mol H2,充分反应后转移电子的数目为0.6NA |
| D、80g NH4NO3晶体中含有NH4+数目为NA |
向明矾溶液中逐渐滴加Ba(OH)2溶液,可能发生反应的离子方程式为( )
| A、2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
| B、Al3++SO42-+Ba2++3OH-→Al(OH)3↓+BaSO4↓ |
| C、2Al3++3SO42-+3Ba2++8OH-→2AlO2-+3BaSO4↓+4H2O |
| D、Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
用石墨电极电解CuCl2溶液(如图).下列分析正确的是( )


| A、通电使CuC12发生电离 |
| B、a端是直流电源的负极 |
| C、阳极上发生的反应:Cu2++2e-→Cu |
| D、通电一段时间后,在阴极附近观察到黄绿色气体 |
 A、B、C、X和Y均为中学常见物质,其中A、B为单质,X、Y为化合物,C为地壳中含量最多的元素形成的单质,它们在一定条件下可发生如图反应,请填空:
A、B、C、X和Y均为中学常见物质,其中A、B为单质,X、Y为化合物,C为地壳中含量最多的元素形成的单质,它们在一定条件下可发生如图反应,请填空: