题目内容
20. 已知反应A(g)+B(g)?nC(g)△H=x kJ•mol-1,在不同条件下进行时,混合物中C的百分含量随时间变化的关系如右图.下列有关叙述一定正确的是( )
已知反应A(g)+B(g)?nC(g)△H=x kJ•mol-1,在不同条件下进行时,混合物中C的百分含量随时间变化的关系如右图.下列有关叙述一定正确的是( )| A. | a条件下的反应速率小于b条件下的反应速率 | |
| B. | 其他条件相同时,a表示有催化剂,b表示无催化剂 | |
| C. | 其他条件相同,若a、b表示不同压强下的反应,则n>2 | |
| D. | 其他条件相同,若a、b表示不同温度下的反应,则x>0 |
分析 A、根据先拐先平衡,速率快判断;
B、加入催化剂同等程度增大正逆反应速率,平衡不移动;
C、压强越大,平衡时C的百分含量(C%)越小,可知正反应为气体物质的量增大的反应,即1<n;
D、a到达平衡时间短,所以a温度高,再根据升温,平衡移动分析.
解答 解:A、因为先拐先平衡,速率快,所以a条件下的反应速率大于b条件下的反应速率,故A错误;
B、加入催化剂同等程度增大正逆反应速率,平衡不移动,则a、b到达平衡时C的百分含量相同,故B错误;
C、a到达平衡时间短,所以a压强高,压强越大,平衡时C的百分含量(C%)越小,可知正反应为气体物质的量增大的反应,即2<n,所以a比b的压强大且n>2,故C正确;
D、a到达平衡时间短,所以a温度高,升温平衡时C的百分含量(C%)减小,平衡逆向移动,所以△H<0,则x<0,故D错误;
故选C.
点评 本题考查了体积分数随温度、压强变化曲线的分析,难度不大,明确“先拐先平数值大”是解本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1 mol NaHSO4晶体中离子总数为2NA | |
| B. | 4.4g 14CO2含中子数为2.4NA | |
| C. | 0.3mol•L-1的NH4NO3溶液中含有的NH4+数目为0.3NA | |
| D. | 1 molFe在氧气中燃烧失去的电子数为3NA |
11.分别往含有下列离子的溶液中通入氯气,离子浓度不会减少的是( )
| A. | Ag+ | B. | HCO3- | C. | I- | D. | Na+ |
8.有些地区水井中的水刚从井中抽出时是清澈透明的,但烧开后发现产生了红褐色的不溶物.某中学研究性学习小组对这种现象进行了分析:向刚抽出的井水中加入硫氰化钾溶液,无明显现象;向产生不溶物的水中加入盐酸,不溶物溶解,再向其中加入硫氰化钾溶液,溶液呈现血红色.则下列说法不正确的是( )
| A. | 该井水中肯定有Fe3+ | |
| B. | 该井水中肯定有Fe2+ | |
| C. | 红褐色不溶物是Fe(OH)3 | |
| D. | 红褐色不溶物是由于氧化和水解产生 |
15.J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
(1)元素T的最高价含氧酸具有强酸性;T在周期表中的位置是第三周期第ⅦA族.
(2)化合物甲的分子由两个J原子和两个氢原子构成,甲的电子式是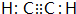 .
.
(3)一定条件下,R元素的最高价氧化物乙在固定容积的密闭容器中发生分解反应(△H>0),达到平衡后,仅改变下表中反应条件x,该平衡体系中随x递增,y递减的是ac(选填序号)
(4)L的最简单气态氢化物丙的水溶液显碱性,在微电子工业中,丙的水溶液可作H2O2的清除剂,反应的产物不污染环境,其化学方程式为NH3+3H2O2=N2+6H2O.
(5)在298K下,J、M的单质各1mol完全燃烧,分别放出热量以akJ和bkJ时.又知一定条件下,M的单质能将J从它的最高价氧化物中置换出来,写出此置换反应的热化学方程式:4Al(s)+3CO2(g)=3C(s)+2Al2O3(s)△H=(+3a-4b)kJ/mol.(注:题中所设单质均为最稳定单质)
(6)用M单质作阳极,J单质作阴极,Ca(HCO3)2溶液作电解液,进行电解,阴极生成的气体和沉淀分别是H2、CaCO3,阳极也生成气体和沉淀,写出阳极的电极反应式Al-3e-+3HCO3-=Al(OH)3+3CO2↑.
| J | ||||
| R |
(2)化合物甲的分子由两个J原子和两个氢原子构成,甲的电子式是
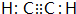 .
.(3)一定条件下,R元素的最高价氧化物乙在固定容积的密闭容器中发生分解反应(△H>0),达到平衡后,仅改变下表中反应条件x,该平衡体系中随x递增,y递减的是ac(选填序号)
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入氧气 | 加入乙的物质 |
| y | 乙的物质的量 | 平衡常数K | 乙的转化率 | 生成物物质的量总和 |
(5)在298K下,J、M的单质各1mol完全燃烧,分别放出热量以akJ和bkJ时.又知一定条件下,M的单质能将J从它的最高价氧化物中置换出来,写出此置换反应的热化学方程式:4Al(s)+3CO2(g)=3C(s)+2Al2O3(s)△H=(+3a-4b)kJ/mol.(注:题中所设单质均为最稳定单质)
(6)用M单质作阳极,J单质作阴极,Ca(HCO3)2溶液作电解液,进行电解,阴极生成的气体和沉淀分别是H2、CaCO3,阳极也生成气体和沉淀,写出阳极的电极反应式Al-3e-+3HCO3-=Al(OH)3+3CO2↑.
9.四种短周期元素在周期表中的位置如图,其中只有M为金属元素,下列说法不正确的是( )
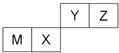

| A. | 原子半径Z<M | |
| B. | Z位于元素周期表中第2周期、第ⅥA族 | |
| C. | X的最简单气态氢化物的热稳定性比Z的小 | |
| D. | X的最高价氧化物不溶于任何酸 |
9.某同学对铜与浓硫酸反应产生的黑色沉淀进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插入浓硫酸,加热;
Ⅱ.待产生黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
(1)甲同学认为根据所学知识:已知硫化铜(CuS)、硫化亚铜(Cu2S)、粉末和氧化铜粉末相似且都不溶于水,在空气中煅烧硫化铜和硫化亚铜都转化二种氧化物,设计一个不用任何化学试剂就能鉴别氧化铜、硫化铜、硫化亚铜三种粉末的简便实验方案,请帮助甲同学将方案填写于下表中,实验提供天平及其他必要的设备.
(2)乙同学查阅文献得知检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+.该同学假设黑色沉淀是CuO.检验过程如下:
①将CuO放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6]溶液,产生红褐色沉淀.
②将黑色沉淀放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀.
由该检验过程所得结论是黑色沉淀中不含有CuO.
(3)丙同学再次假设,黑色沉淀是铜的硫化物.实验如下:
①现象2说明黑色沉淀具有还原性.
②能确认黑色沉淀中含有S元素的现象是B试管中出现白色沉淀,相应的离子方程式是NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+.
③为确认黑色沉淀是“铜的硫化物”,还需进行的实验操作是取冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,说明黑色沉淀是铜的硫化物.
以上实验说明,黑色沉淀中存在铜的硫化物.进一步实验后证明黑色沉淀是CuS与Cu2S的混合物.将黑色沉淀放入浓硫酸中加热一段时间后,沉淀溶解,其中CuS溶解的化学方程式是CuS+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+4SO2↑+4H2O.
(4)丁同学通过实验确认,固体只含有硫化铜和硫化亚铜,他通过以下实验求硫化亚铜的百分含量:取2g Cu2S和CuS的混合物在酸性溶液中用400mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL 0.1mol/L(NH4)2Fe(SO4)2溶液完全反应.
则混合物中Cu2S的质量分数为40%.
Ⅰ.将光亮铜丝插入浓硫酸,加热;
Ⅱ.待产生黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
(1)甲同学认为根据所学知识:已知硫化铜(CuS)、硫化亚铜(Cu2S)、粉末和氧化铜粉末相似且都不溶于水,在空气中煅烧硫化铜和硫化亚铜都转化二种氧化物,设计一个不用任何化学试剂就能鉴别氧化铜、硫化铜、硫化亚铜三种粉末的简便实验方案,请帮助甲同学将方案填写于下表中,实验提供天平及其他必要的设备.
| 实验步骤 | 实验现象 | 结论及有关化学方程式 |
| A.分别称取相同质量的样品,在空气中燃烧; B.分别称量硫化铜和硫化亚铜灼烧后剩余物质的质量 | A.有一种固体无变化,两种固体产生刺激性气味气体 B.有一种样品质量减轻,一种样品质量不变 | A.固体无变化的是氧化铜,产生刺激性气味气体的是硫化铜和硫化亚铜,在空气中煅烧中反应的化学方程式分别为2CuS+3O2 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO+2SO2; Cu2S+2O2 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2 B.质量减轻的是硫化铜,质量不变的是硫化亚铜 |
①将CuO放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6]溶液,产生红褐色沉淀.
②将黑色沉淀放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀.
由该检验过程所得结论是黑色沉淀中不含有CuO.
(3)丙同学再次假设,黑色沉淀是铜的硫化物.实验如下:
| 实验装置 | 现象 |
 | 1.A试管中黑色沉淀逐渐溶解 2.A试管内上方出现红棕色气体 3.B试管中出现白色沉淀 |
②能确认黑色沉淀中含有S元素的现象是B试管中出现白色沉淀,相应的离子方程式是NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+.
③为确认黑色沉淀是“铜的硫化物”,还需进行的实验操作是取冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,说明黑色沉淀是铜的硫化物.
以上实验说明,黑色沉淀中存在铜的硫化物.进一步实验后证明黑色沉淀是CuS与Cu2S的混合物.将黑色沉淀放入浓硫酸中加热一段时间后,沉淀溶解,其中CuS溶解的化学方程式是CuS+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+4SO2↑+4H2O.
(4)丁同学通过实验确认,固体只含有硫化铜和硫化亚铜,他通过以下实验求硫化亚铜的百分含量:取2g Cu2S和CuS的混合物在酸性溶液中用400mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL 0.1mol/L(NH4)2Fe(SO4)2溶液完全反应.
则混合物中Cu2S的质量分数为40%.



