题目内容
下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)在③~⑦元素中,原子半径最大的元素其离子结构示意图为
(2)按要求写出下列两种物质的电子式:①的氢化物 ;碱性最强的最高价氧化物的对应的水化物 ;
(3)在⑦与⑩的单质中,化学性质较活泼的是 (填化学式),可用什么化学反应说明该事实(写出反应的化学方程式): .
| 主族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)按要求写出下列两种物质的电子式:①的氢化物
(3)在⑦与⑩的单质中,化学性质较活泼的是
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为Cl、⑧为Ar、⑨为K、⑩为Br.
(1)同周期自左而右原子半径减小,在③~⑦元素中原子半径最大的为Na,钠离子质子数为11,核外有10个电子层,有2个电子层,各电子数为2、8;
(2)①的氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对;碱性最强的最高价氧化物的对应的水化物为KOH,由钾离子与氢氧根离子构成;
(3)同主族自上而下非金属性减弱,单质活泼性减弱,可以用单质之间的相互置换说明该事实.
(1)同周期自左而右原子半径减小,在③~⑦元素中原子半径最大的为Na,钠离子质子数为11,核外有10个电子层,有2个电子层,各电子数为2、8;
(2)①的氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对;碱性最强的最高价氧化物的对应的水化物为KOH,由钾离子与氢氧根离子构成;
(3)同主族自上而下非金属性减弱,单质活泼性减弱,可以用单质之间的相互置换说明该事实.
解答:
解:由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为Cl、⑧为Ar、⑨为K、⑩为Br.
(1)同周期自左而右原子半径减小,在③~⑦元素中原子半径最大的为Na,钠离子质子数为11,核外有10个电子层,有2个电子层,各电子数为2、8,钠离子结构示意图为: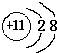 ,
,
故答案为: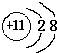 ;
;
(2)①的氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对,电子式为: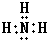 ;碱性最强的最高价氧化物的对应的水化物为KOH,由钾离子与氢氧根离子构成,电子式为:
;碱性最强的最高价氧化物的对应的水化物为KOH,由钾离子与氢氧根离子构成,电子式为: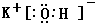 ,
,
故答案为: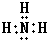 ;
;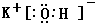 ;
;
(3)同主族自上而下非金属性减弱,单质活泼性减弱,故活泼性Cl2>Br2,可以用单质之间的相互置换说明该事实,反应方程式为:Cl2+2KBr═2KCl+Br2,
故答案为:Cl2;Cl2+2KBr═2KCl+Br2.
(1)同周期自左而右原子半径减小,在③~⑦元素中原子半径最大的为Na,钠离子质子数为11,核外有10个电子层,有2个电子层,各电子数为2、8,钠离子结构示意图为:
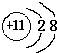 ,
,故答案为:
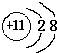 ;
;(2)①的氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对,电子式为:
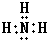 ;碱性最强的最高价氧化物的对应的水化物为KOH,由钾离子与氢氧根离子构成,电子式为:
;碱性最强的最高价氧化物的对应的水化物为KOH,由钾离子与氢氧根离子构成,电子式为: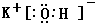 ,
,故答案为:
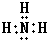 ;
;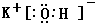 ;
;(3)同主族自上而下非金属性减弱,单质活泼性减弱,故活泼性Cl2>Br2,可以用单质之间的相互置换说明该事实,反应方程式为:Cl2+2KBr═2KCl+Br2,
故答案为:Cl2;Cl2+2KBr═2KCl+Br2.
点评:本题考查元素周期表与元素周期律综合应用,难度不大,注意掌握元素金属性、非金属性强弱比较.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
能在水溶液中大量共存的一组离子是( )
| A、H+、Fe3+、I-、SO42- |
| B、Al3+、Mg2+、HCO3-、Cl- |
| C、K+、Ag+、Ca2+、PO43- |
| D、NH4+、Na+、SO42-、Cl- |
某反应过程中体系的能量变化如图所示,下列说法错误的是( )
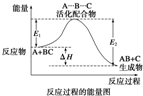

A、反应过程可表示为
| ||||||
| B、E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能 | ||||||
| C、正反应的热效应为△H=E1-E2<0,所以正反应为放热反应 | ||||||
| D、此图中逆反应的热效应△H=E1-E2<0,所以逆反应为放热反应 |
 化学反应原理在工业生产中具有十分重要的意义.
化学反应原理在工业生产中具有十分重要的意义.