题目内容
在一定条件下,氯气与碘单质以等物质的量进行反应,可得到一种红棕色液体ICl,ICl有很强的氧化性.现有下列两个反应:①2ICl+2Zn=ZnCl2+ZnI2;②ICl+H2O=HCl+HIO.下列关于ICl性质的叙述正确的是( )
| A、反应①中,当转移0.4mol电子时生成13.6g ZnCl2 |
| B、反应①中,ZnCl2是氧化产物,ZnI2是还原产物 |
| C、反应①中,ZnCl2既是氧化产物又是还原产物 |
| D、反应②中,ICl既是氧化剂又是还原剂 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:①2ICl+2Zn=ZnCl2+ZnI2中,Zn元素的化合价由0升高为+2价,I元素的化合价由+1价降低为-1价;
②ICl+H2O=HCl+HIO中不存在元素的化合价变化,以此来解答.
②ICl+H2O=HCl+HIO中不存在元素的化合价变化,以此来解答.
解答:
解:A.反应①中,当转移0.4mol电子时生成0.1molZnCl2,则质量为0.1mol×136g/mol=13.6g,故A正确;
B.反应①中,Zn元素的化合价升高,则ZnI2、ZnCl2是氧化产物,I元素的化合价降低,则ZnI2是还原产物,故B错误;
C.由B的分析可知,反应①中,ZnCl2是氧化产物,故C错误;
D.反应②中,不存在元素的化合价变化,ICl既不是氧化剂又不是还原剂,故D错误;
故选A.
B.反应①中,Zn元素的化合价升高,则ZnI2、ZnCl2是氧化产物,I元素的化合价降低,则ZnI2是还原产物,故B错误;
C.由B的分析可知,反应①中,ZnCl2是氧化产物,故C错误;
D.反应②中,不存在元素的化合价变化,ICl既不是氧化剂又不是还原剂,故D错误;
故选A.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应的基本概念及电子转移的考查,题目难度不大.

练习册系列答案
相关题目
化学与人类生活、社会可持续发展密切相关.下列说法不正确的是( )
| A、如将某材料分散到液体分散剂中,该分散系可发生丁达尔效应,由此可推测该材料粒子的直径为1~100nm之间 |
| B、质谱法是测定有机物组成和结构的现代分析方法之一,同位素示踪法是科学家经常使用的研究化学反应历程的手段之一 |
| C、发酵粉中含有苏打,能使焙制出的糕点疏松多孔 |
| D、高空臭氧层吸收太阳紫外线,保护地球生物;低空臭氧是污染气体,对人体有危害 |
针对实验室制取氨气,下列说法不正确的是( )
| A、发生装置与用KClO3制取O2的装置相同 |
| B、可用排饱和氯化铵溶液的方法收集氨气 |
| C、氨气的验满可以用湿润的红色石蕊试纸或沾有浓盐酸的玻璃棒放于试管口附近 |
| D、所用的铵盐不是NH4NO3,是因为NH4NO3受热易爆炸 |
120mL含有0.20mol碳酸钠的溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
| A、2.0 mol/L |
| B、1.5 mol/L |
| C、0.18 mol/L |
| D、0.24 mol/L |
氨基酸不能发生的反应是( )
| A、酯化反应 | B、与碱的中和反应 |
| C、成肽反应 | D、水解反应 |
应避光、低温、密封储存的物质是( )
| A、HNO3 |
| B、KOH |
| C、NaCl |
| D、CuSO4 |
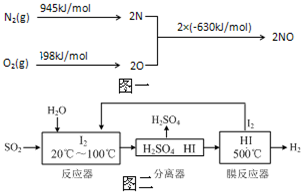 中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题: