题目内容
下列离子方程式书写正确的是( )
| A、铜屑中加入足量氯化铁溶液:Fe3++Cu=Fe2++Cu2+ |
| B、大理石中加入足量浓盐酸:CaCO3+2H+=Ca2++CO2↑+H2O |
| C、向BaCl2溶液中通入CO2气体,出现白色沉淀:Ba2++CO2+H2O=BaCO3↓+2H+ |
| D、碳酸氢铵溶液中加入足量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.电荷不守恒;
B.碳酸钙和盐酸反应生成氯化钙、二氧化碳和水;
C.二氧化碳和氯化钡不反应;
D.二者反应生成碳酸钠、一水合氨和水.
B.碳酸钙和盐酸反应生成氯化钙、二氧化碳和水;
C.二氧化碳和氯化钡不反应;
D.二者反应生成碳酸钠、一水合氨和水.
解答:
解:A.电荷不守恒,离子方程式为2Fe3++Cu=2Fe2++Cu2+,故A错误;
B.碳酸钙和盐酸反应生成氯化钙、二氧化碳和水,离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O,故B正确;
C.盐酸的酸性大于碳酸,所以二氧化碳和氯化钡不反应,没有离子方程式,故C错误;
D.二者反应生成碳酸钠、一水合氨和水,离子方程式为NH4++HCO3-+2OH-=CO32-+H2O+NH3.H2O,故D错误;
故选B.
B.碳酸钙和盐酸反应生成氯化钙、二氧化碳和水,离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O,故B正确;
C.盐酸的酸性大于碳酸,所以二氧化碳和氯化钡不反应,没有离子方程式,故C错误;
D.二者反应生成碳酸钠、一水合氨和水,离子方程式为NH4++HCO3-+2OH-=CO32-+H2O+NH3.H2O,故D错误;
故选B.
点评:本题考查了离子方程式的书写,根据物质之间的反应及离子反应书写规则来分析解答,易错选项是D,反应物的量不同其产物不同,为易错点.

练习册系列答案
相关题目
在等体积的AlCl3、MgCl2、NaCl三种溶液中,分别加入等量的AgNO3溶液,恰好都完全反应,则以上三种溶液的物质的量浓度之比为( )
| A、2:3:6 |
| B、6:3:2 |
| C、1:3:2 |
| D、3:2:1 |
某元素原子的原子核外有三个电子层,最外层电子数是5.该原子核内的质子数是( )
| A、14 | B、15 | C、16 | D、17 |
下列各组物质中所含微粒数相同的是( )
| A、9g H2O和0.5mol Br2中所含的原子数 |
| B、0.5mol Na2SO4和1L 0.5 mol/L的NaOH溶液中所含的Na+ |
| C、2240mLCO(标准状况)和0.1mol N2中所含的原子数 |
| D、5.6L氮气(标准状况)和22gCO2所含的分子数 |
设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A、22.4L Cl2中含有NA个Cl2分子 |
| B、1mol Na2SO4中有4NA个O原子 |
| C、在不同温度和压强下,1 molH2与1 molO2的体积不同,分子数也不同 |
| D、1 mol任何物质在标况下的体积均为22.4L |
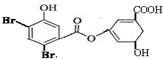 已知,某有机物其结构如图所示,关于该物质的说法正确的是( )
已知,某有机物其结构如图所示,关于该物质的说法正确的是( )| A、1mol该物质最多消耗NaOH为7mol |
| B、滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 |
| C、该物质与苯酚属于同系物,遇FeCl3溶液呈紫色 |
| D、可与NaHCO3溶液反应放出CO2气体 |
根据下表中烃的分子式排列规律,判断空格中烃的一氯代物的同分异构体数目是( )
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
| A、6 | B、7 | C、8 | D、9 |
Mg、Al两种金属分别跟同体积、同浓度的稀H2SO4反应,同温同压下生成氢气的体积相同,则Mg、Al两种金属之间的量的关系一定正确的是( )
| A、两个反应电子转移的数目相等 |
| B、加入镁、铝质量比为4:3 |
| C、金属溶解的物质的量相等 |
| D、加入的两种金属质量不等 |
用NA表示阿伏加德罗常数数值,下列叙述正确的是( )
| A、64g SO2中含有的氧原子数为1NA |
| B、物质的量浓度为0.5 mol?L-1的MgCl2溶液,含有Cl-数为1NA |
| C、常温常压下,14g N2含有分子数为0.5NA |
| D、标准状况下,22.4L H2O的分子数为1NA |