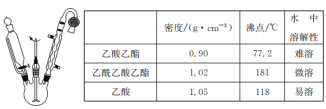
题目内容
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,4.48L 空气中所含原子数为0.2NA
B.常温常压下,2.3g NO2和N2O4的混合物中含有的氧原子数为0.2NA
C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2 NA
D.常温下,0.1 mol·L-1Na2CO3溶液中阴离子总数大于0.1 NA
【答案】C
【解析】
A.标况下4.48L 空气的物质的量为0.2mol,但空气中的分子有双原子分子和三原子分子,故所含原子数要大于0.2NA,故A错误;
B.常温常压下,2.3g NO2和N2O4的混合物含有最简式NO2物质的量为:![]() =0.05mol,含有的氧原子数为0.05mol×2×NA=0.1NA,故B错误;
=0.05mol,含有的氧原子数为0.05mol×2×NA=0.1NA,故B错误;
C.过氧化钠和水的反应为歧化反应,生成1mol氧气转移2mol电子,则当生成0.1mol氧气时,转移0.2NA个电子,故C正确;
D.依据n=cV可知,溶液体积未知无法计算微粒数目,故D错误;
故选C。

练习册系列答案
相关题目