题目内容
【题目】有机物A有如下转化关系:
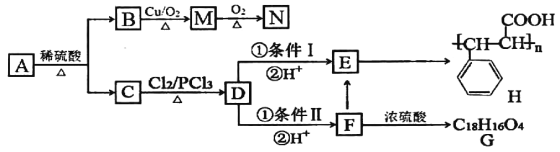
已知:①有机物B是芳香烃的含氧衍生物,其相对分子质量为108,B中氧的质量分数为14.8%。
②CH3-CH2-COOH+Cl2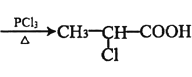 +HCl
+HCl
根据以上信息,回答下列问题:
(1)B的分子式为___________;有机物D中含氧官能团名称是_____________。
(2)A的结构简式为_________________ ;检验M中官能团的试剂是______________。
(3)条件I为_________________;D→F的反应类型为________________。
(4)写出下列转化的化学方程式:
F→E______________________________________
F→G_____________________________________。
(5)N的同系物X比N相对分子质量大14,符合下列条件的X的同分异构体有_________种(不考虑立体异构),写出其中核磁共振氢谱有五组峰,且吸收峰的面积之比为1∶1∶2∶2∶2的同分异构体的结构简式______________(写一种)。
①含有苯环; ②能发生银镜反应; ③遇FeCl3溶液显紫色。
【答案】C7H8O 羧基 ![]() 银氨溶液或新制氢氧化铜悬浊液 NaOH的醇溶液,加热 水解反应(或取代反应)
银氨溶液或新制氢氧化铜悬浊液 NaOH的醇溶液,加热 水解反应(或取代反应)  +H2O
+H2O  +2H2O 13
+2H2O 13 ![]()
【解析】
有机物B是芳香烃的含氧衍生物,其相对分子质量为108,B中氧的质量分数为14.8%,B中O原子个数=![]() =1,碳原子个数=
=1,碳原子个数=![]() =7…8,所以B分子式为C7H8O,B中含有苯环且能连续被氧化,则B为
=7…8,所以B分子式为C7H8O,B中含有苯环且能连续被氧化,则B为![]() ,B被催化氧化生成M,M为
,B被催化氧化生成M,M为![]() ,N为苯甲酸,结构简式为
,N为苯甲酸,结构简式为 ;
;
A发生水解反应生成醇和羧酸,C为羧酸,根据题给信息知,C发生取代反应生成D,D发生反应然后酸化得到E,E能生成H,D是含有氯原子的羧酸,则D在氢氧化钠的醇溶液中加热生成E,E发生加聚反应生成H,所以D为 、E为
、E为![]() 、C为
、C为![]() ;D反应生成F,F能反应生成E,则D发生水解反应生成F,F为
;D反应生成F,F能反应生成E,则D发生水解反应生成F,F为![]() ,F发生酯化反应生成G,根据G分子式知,G为
,F发生酯化反应生成G,根据G分子式知,G为 ;根据B、C结构简式知,A为
;根据B、C结构简式知,A为![]() ,以此解答该题。
,以此解答该题。
(1)B为![]() ,分子式为C7H8O,D为
,分子式为C7H8O,D为 ,含氧官能团为羧基;
,含氧官能团为羧基;
(2)由以上分析可知A为![]() ,M为
,M为![]() ,含有醛基,可用银氨溶液或新制备氢氧化铜浊液检验;
,含有醛基,可用银氨溶液或新制备氢氧化铜浊液检验;
(3)通过以上分析知,条件I为氢氧化钠的醇溶液、加热;D为 ,D发生水解反应(取代反应)生成F;
,D发生水解反应(取代反应)生成F;
(4)F发生消去反应生成E,反应方程式为 +2H2O,F发生酯化反应生成G,反应方程式为
+2H2O,F发生酯化反应生成G,反应方程式为 +2H2O;
+2H2O;
(5)N为苯甲酸,结构简式为 ,X是N的同系物,相对分子质量比N大14,即X中含有羧基,且分子中碳原子数比N多一个,根据条件:①含有苯环②能发生银镜反应,说明含有醛基,③遇FeCl3溶液显紫色,说明含有酚羟基,如苯环含有2个取代基,则分别为-CH2CHO、-OH,有邻、间、对3种,如苯环含有3个取代基,可为-CH3、-CHO、-OH,有10种,共13种;
,X是N的同系物,相对分子质量比N大14,即X中含有羧基,且分子中碳原子数比N多一个,根据条件:①含有苯环②能发生银镜反应,说明含有醛基,③遇FeCl3溶液显紫色,说明含有酚羟基,如苯环含有2个取代基,则分别为-CH2CHO、-OH,有邻、间、对3种,如苯环含有3个取代基,可为-CH3、-CHO、-OH,有10种,共13种;
其中核磁共振氢谱有五组峰,且吸收峰的面积之比为1:1:2:2:2的同分异构体的结构简式为![]() 。
。

【题目】甲、乙两个实验小组利用![]() 酸性溶液与
酸性溶液与![]() 溶液反应研究影响反应速率的因素。
溶液反应研究影响反应速率的因素。
设计实验方案如下![]() 实验中所用
实验中所用![]() 溶液均已加入
溶液均已加入![]() :
:
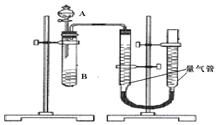
甲组:通过测定单位时间内生成![]() 气体体积的大小来比较化学反应速率的大小某同学进行实验,实验装置如图.其中A、B的成分见表
气体体积的大小来比较化学反应速率的大小某同学进行实验,实验装置如图.其中A、B的成分见表
序号 | A溶液 | B溶液 |
① |
|
|
② |
|
|
③ |
|
|
![]() 该反应的离子方程式为 ______
该反应的离子方程式为 ______
![]() 实验开始前需要检查气密性.分液漏斗中A溶液应该 ______ 加入
实验开始前需要检查气密性.分液漏斗中A溶液应该 ______ 加入![]() 填“一次性”或“逐滴滴加”
填“一次性”或“逐滴滴加”![]()
![]() 完成该实验还需要 ______
完成该实验还需要 ______ ![]() 填仪器名称
填仪器名称![]() ,实验结束后读数前需要移动量气管,使两个量气管的液面相平.
,实验结束后读数前需要移动量气管,使两个量气管的液面相平.
乙组:通过测定![]() 溶液褪色所需时间的多少来比较化学反应速率为了探究
溶液褪色所需时间的多少来比较化学反应速率为了探究![]() 与
与![]() 浓度对反应速率的影响,某同学在室温下完成以下实验
浓度对反应速率的影响,某同学在室温下完成以下实验
实验编号 | 1 | 2 | 3 | 4 |
水 | 10 | 5 | 0 | X |
| 5 | 10 | 10 | 5 |
| 5 | 5 | 10 | 10 |
时间 | 40 | 20 | 10 | --- |
![]() ______ ,4号实验中始终没有观察到溶液褪色,你认为可能的原因是 ______ 。
______ ,4号实验中始终没有观察到溶液褪色,你认为可能的原因是 ______ 。
![]() 号反应中,
号反应中,![]() 的反应速率为 ______。
的反应速率为 ______。
![]() 在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
时间 | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
温度℃ | 25 | 26 | 26 | 26 |
| 27 | 27 |
结合实验目的与表中数据,你得出的结论是 ______。
![]() 从影响化学反应速率的因素看,你的猜想还可能是 ______ 的影响。若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是 ______
从影响化学反应速率的因素看,你的猜想还可能是 ______ 的影响。若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是 ______ ![]() 填字母
填字母![]() 。
。
A 硫酸钾![]() 水
水![]() 二氧化锰
二氧化锰![]() 硫酸锰。
硫酸锰。
【题目】(1)已知:①CO燃烧热为283.0kJ·mol-l,②N2(g)+O2(g) =2NO(g) △H=+180.5kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应,能消除污染,写出该反应的热化学方程式______________。
(2)某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应:
)在刚性容器内发生反应:![]() (g)+ I2(g)
(g)+ I2(g)![]()
![]() (g)+2HI(g) ΔH=+89.3 kJ·mol 1,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为____,该反应的平衡常数Kp=____Pa(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有____(填标号)。
(g)+2HI(g) ΔH=+89.3 kJ·mol 1,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为____,该反应的平衡常数Kp=____Pa(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有____(填标号)。
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
(3)室温下,烟气中的SO2可用某浓度的NaOH溶液吸收得到pH=7的溶液,试计算所得溶液中![]() =_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
=_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
(4)烟气中的SO2也可用Na2SO3溶液吸收,吸收过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 99:1 | 1:1 | 1:99 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液呈中性时,溶液中离子浓度由小到大的顺序为___________。
【题目】下列根据实验现象得出的结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 废FeCl3蚀刻液X中加入少量铁粉,振荡 | 得到澄清溶液 | X中一定不含Cu2+ |
B | 浓度均为0.1molL-1的Na2CO3和Na2S混合溶液中,滴入少量AgNO3溶液 | 产生黑色沉淀 | Ksp(Ag2S)大于Ksp(Ag2CO3) |
C | KNO3和KOH混合溶液中加入铝粉并加热,管口放湿润的红色石蕊试纸 | 试纸变为蓝色 | NO3-还原为NH3 |
D | KBrO3溶液中加入少量苯,然后通入少量Cl2 | 有机相呈橙色 | 氧化性:Cl2>Br2 |
A.AB.BC.CD.D