题目内容
【题目】乙酰乙酸乙酯是有机合成中非常重要的原料,实验室制备乙酰乙酸乙酯的反应原理、装置示意图和有关数据如下所示:

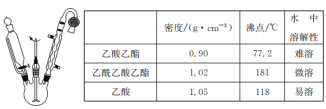
实验步骤:
Ⅰ.合成:向三颈烧瓶中加入9.8ml无水乙酸乙酯,迅速加入0.1g切细的金属钠。水浴加热反应液,缓慢回流约2h至金属钠全部反应完。停止加热,冷却后向反应混合物中加入50%乙酸至反应液呈弱酸性。
Ⅱ.分离与提纯:
①向反应混合物中加入等体积的饱和食盐水,分离得到有机层。
②水层用5mL无水乙酸乙酯萃取,分液。
③将①②所得有机层合并,洗涤、干燥、蒸馏得到乙酰乙酸乙酯粗产品。
④蒸馏粗产品得到乙酰乙酸乙酯3.9g。
(1)球形冷凝管中冷却水从______(填“上”或“下”)口进入,上方干燥管中盛无水CaCl2,其作用是________。
(2)实验室制备乙酰乙酸乙酯时,通常在无水乙酸乙酯中加入微量的无水乙醇,其作用是___。
(3)分离与提纯操作①中使用的分离仪器是________。加入饱和食盐水的作用是 _______。
(4)分离与提纯操作③用饱和NaHCO3溶液洗涤的目的是 _______。
(5)本实验的产率为_______ %(结果保留两位有效数字)。
【答案】下 防止空气中的水蒸气进入反应装置 乙醇与钠反应生成乙醇钠,乙醇钠作催化剂,加快反应速率 分液漏斗 盐析,降低乙酰乙酸乙酯在水中的溶解度,有利于分层 除去乙酸 60
【解析】
(1)冷却水从下口进,从上口出,冷凝效果较好;无水CaCl2为干燥剂,防止空气中的水蒸气进入反应装置;
(2)乙醇与钠反应生成乙醇钠;
(3)分离互不相溶且密度不同的两种液体的操作方法为分液;加入饱和食盐水的作用是盐析;
(4)饱和NaHCO3溶液与乙酸反应,结合分离提纯的思路分析;
(5)9.8mL无水乙酸乙酯的质量为:9.8mL×0.9g/mL=8.82g,根据理论上生成乙酰乙酸乙酯的质量,结合蒸馏粗产品得到乙酰乙酸乙酯3.9g可计算出本实验的产率。
(1)为增加冷凝效果,球形冷凝管的冷却水从下口进入,从上口出;上方干燥管中盛有无水CaCl2,其作用是防止空气中的水蒸气进入反应装置,
故答案为:下; 防止空气中的水蒸气进入反应装置;
(2)实验室制备乙酰乙酸乙酯时,装置中有切细的金属钠,加入微量的无水乙醇,其作用是乙醇与钠反应生成乙醇钠,乙醇钠作催化剂,加快反应速率,
故答案为:乙醇与钠反应生成乙醇钠,乙醇钠作催化剂,加快反应速率;
(3)分离互不相溶且密度不同的两种液体对应的操作为分液,使用的分离仪器是分液漏斗;加入饱和食盐水的作用是盐析,降低乙酰乙酸乙酯在水中的溶解度,有利于分层,
故答案为:分液漏斗;盐析,降低乙酰乙酸乙酯在水中的溶解度,有利于分层;
(4)混合后的有机层中含有乙酸,NaHCO3与乙酸反应生成乙酸钠溶于水,乙酸钠难溶于乙酰乙酸乙酯,分离与提纯操作③用饱和NaHCO3溶液洗涤的目的是除去乙酸,
故答案为:除去乙酸;
(5)9.8mL无水乙酸乙酯的质量为:9.8mL×0.9g/mL=8.82g,理论上生成乙酰乙酸乙酯的质量为:![]() g=6.51g,蒸馏粗产品得到乙酰乙酸乙酯3.9g,则本实验的产率为:
g=6.51g,蒸馏粗产品得到乙酰乙酸乙酯3.9g,则本实验的产率为:![]() ×100%≈60%,
×100%≈60%,
故答案为:60。

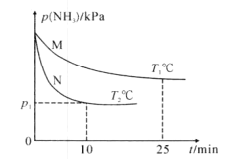
【题目】(1)已知:①CO燃烧热为283.0kJ·mol-l,②N2(g)+O2(g) =2NO(g) △H=+180.5kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应,能消除污染,写出该反应的热化学方程式______________。
(2)某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应:
)在刚性容器内发生反应:![]() (g)+ I2(g)
(g)+ I2(g)![]()
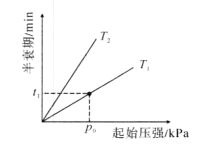
![]() (g)+2HI(g) ΔH=+89.3 kJ·mol 1,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为____,该反应的平衡常数Kp=____Pa(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有____(填标号)。
(g)+2HI(g) ΔH=+89.3 kJ·mol 1,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为____,该反应的平衡常数Kp=____Pa(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有____(填标号)。
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
(3)室温下,烟气中的SO2可用某浓度的NaOH溶液吸收得到pH=7的溶液,试计算所得溶液中![]() =_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
=_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
(4)烟气中的SO2也可用Na2SO3溶液吸收,吸收过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 99:1 | 1:1 | 1:99 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液呈中性时,溶液中离子浓度由小到大的顺序为___________。