题目内容
将铁粉和铜粉组成的均匀混合物10.4 g放入适当容器中,加入一定量的稀硝酸,充分反应后生成NO气体2.24L(标准状况),溶液中还有固体未溶解,测得剩余固体质量为1.6 g.
(1)已知还原性Cu>Fe2+,通过计算判断剩余固体中是否含有铁粉.
(2)计算原混合物中铁和铜的物质的量.
(1)已知还原性Cu>Fe2+,通过计算判断剩余固体中是否含有铁粉.
(2)计算原混合物中铁和铜的物质的量.
考点:有关混合物反应的计算
专题:守恒法
分析:(1)假设剩余金属中含有Fe,则Cu未参加反应,反应生成Fe(NO3)2,根据电子转移守恒计算参加反应Fe的质量,与实际消耗金属质量比较判断;
(2)设混合物中Fe的物质的量为xmol,Cu的物质的量为ymol,结合(1)中判断参加反应的物质,根据电子守恒列方程,再根据总质量列方程,联立方程计算解答.
(2)设混合物中Fe的物质的量为xmol,Cu的物质的量为ymol,结合(1)中判断参加反应的物质,根据电子守恒列方程,再根据总质量列方程,联立方程计算解答.
解答:
解:(1)假设剩余金属中含有Fe,则Cu未参加反应,反应生成Fe(NO3)2,NO的物质的量为
=0.1mol,根据电子转移守恒,参加反应Fe的质量为
=0.15mol,参加反应Fe质量为0.15mol×56g/mol=8.4g<10.4g-1.6g=8.8g,故一定有Cu参与反应,剩余金属一定不含Fe,
答:剩余固体中一定不含铁粉;
(2)设混合物中Fe的物质的量为xmol,Cu的物质的量为ymol,
由二者质量可得:56x+64y=10.4
参加反应Cu为ymol-
=(y-0.025)mol,
根据电子转移守恒,有:2x+2(y-0.025)=0.1×3
联立方程解得:x=0.1 y=0.075
答:混合物中Fe为 0.1mol,Cu为 0.075mol.
| 2.24L |
| 22.4L/mol |
| 0.1mol×3 |
| 2 |
答:剩余固体中一定不含铁粉;
(2)设混合物中Fe的物质的量为xmol,Cu的物质的量为ymol,
由二者质量可得:56x+64y=10.4
参加反应Cu为ymol-
| 1.6g |
| 64g/mol |
根据电子转移守恒,有:2x+2(y-0.025)=0.1×3
联立方程解得:x=0.1 y=0.075
答:混合物中Fe为 0.1mol,Cu为 0.075mol.
点评:本题考查混合物计算,利用假设法判断剩余固体的组成是关键,注意守恒法的应用,难度中等.

练习册系列答案
相关题目
下列实验方案与现象能说明溶液中一定大量存在相应离子的是( )
A、NH4+:试液
| |||||
B、I-:试液
| |||||
C、HCO3-:试液
| |||||
D、Fe2+:试液
|
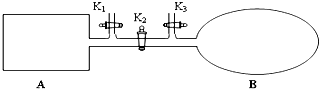 如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,将各1mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L.
如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,将各1mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L.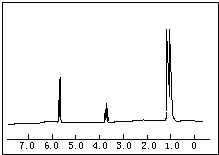 已知1-丙醇和2-丙醇的结构简式如图:
已知1-丙醇和2-丙醇的结构简式如图: