题目内容
12.下列物质间的反应中,属于加成反应的是( )| A. | 苯与Fe、Br2混合 | B. | 氯乙烷和NaOH溶液共热 | ||
| C. | 溴乙烷和NaOH的乙醇溶液共热 | D. | 乙烯和溴水反应 |
分析 有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应,据此有机物的结构进行判断.
解答 解:A、苯和铁、溴混合后,溴原子取代了苯环上的H原子,生成溴苯和HBr,属于取代反应,故A错误;
B、氯乙烷和氢氧化钠共热时,-OH取代了-Cl,生成乙醇和NaCl,属于取代反应,故B错误;
C、溴乙烷和氢氧化钠的乙醇溶液共热时,溴乙烷中的-Br和其所在C的相邻C上的H原子形成HBr脱下来,和氢氧化钠生成NaBr和水,溴乙烷变为乙烯,属于消去反应,故C错误;
D、乙烯和溴水反应时,乙烯中的碳碳双键打开,两个-Br分别加到双键两端的碳原子上,故属于加成反应,故D正确.
故选D.
点评 本题考查有机反应类型,难度不大,注意掌握有机反应类型概念,侧重学生对基础知识的巩固理解.

练习册系列答案
相关题目
2.已知某化学反应的反应物总能量小于生成物总能量,则该反应一定是( )
| A. | 放热反应 | B. | 化合反应 | C. | 吸热反应 | D. | 分解反应 |
3.1999年是人造元素丰收年,一年间得到了核电荷数分别为114、116和118三种新元素,已知核电荷数为118的新元素的一种原子的质量数为293,则该原子中子与电子数之差为( )
| A. | 0 | B. | 57 | C. | 118 | D. | 175 |
20.下列反应既属于非氧化还原反应,又属于吸热反应的是( )
| A. | 铝片和稀盐酸反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与二氧化碳的反应 | D. | 甲烷在氧气中的燃烧 |
7.x、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知( )
| A. | x的原子半径大于y的原子半径 | |
| B. | x的第一电离能小于y 的第一电离能 | |
| C. | x阴离子的半径小于y阳离子的半径 | |
| D. | x的电负性大于y的电负性 |
1.第3周期元素R,它的原子核外层上达到饱和所需电子数小于次外层和最内层电子数之差,且等于最内层电子数的正整数倍.则关于R的正确说法是( )
| A. | 常温下,能稳定存在的R的高价氧化物都能与烧碱溶液反应 | |
| B. | R的最高价氧化物对应水化物是强酸 | |
| C. | R和R的氧化物的熔点和硬度都很高 | |
| D. | R能形成稳定的气态氢化物 |
2.能源、环境与人类生活密切相关,研究它们的综合利用有重要意义.
Ⅰ.二甲醚可代替汽油作新型清洁燃料.常温常压下,二氧化碳加氢可选择性生产二甲醚(CH3OCH3)或一氧化碳.已知二甲醚、氢气的燃烧热分别为-1455kJ/mol,-285.8kJ/mol
(1)写出CO2加氢转化为CH3OCH3(g)和H2O(l)的热化学方程式2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(l)△H=-259.8kJ•mol-1,该反应的平衡常数的表达式为)
$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$..
(2)等物质的量的CO和H2在一定条件下可合成CH3OCH3,同时还产生了一种可参与大气循环的无机化合物,该反应的化学方程式为:3CO+3H2═CH3OCH3+CO2.
(3)二甲醚燃料电池原理如图1所示
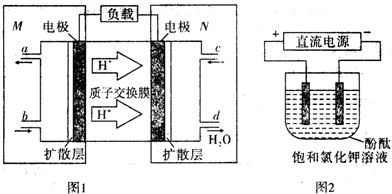
①M区发生的电极反应式为CH3OCH3+3H2O-12e-=2CO2+12H+.
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗CH3OCH3的质量为0.24g(假设溶液电解前后体积不变,保留2位有效数字).
Ⅱ.硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1
(1)下列说法中可以说明该反应已达到平衡状态的是bd
a.体系内混合气体的密度保持不变 h.v(NO2)正=v(SO3)逆
c.容器内气体的总压强保持不变 d.NO体积分数不再改变
(2)某温度下,NO2(g)+SO2(g)?SO3(g)+NO(g)的平衡常数K=$\frac{9}{4}$,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如表所示,
①10min后,甲中达到平衡,则甲中反应的平均速率v(NO2)=0.006mol/(L•min).
②丙达到平衡所用的时间<10min(填“<”“>”“=”),达到平衡后,设甲、乙、丙中SO2(g)的转化率分别为a、b、c,则三者的大小关系为a=c<b.
Ⅰ.二甲醚可代替汽油作新型清洁燃料.常温常压下,二氧化碳加氢可选择性生产二甲醚(CH3OCH3)或一氧化碳.已知二甲醚、氢气的燃烧热分别为-1455kJ/mol,-285.8kJ/mol
(1)写出CO2加氢转化为CH3OCH3(g)和H2O(l)的热化学方程式2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(l)△H=-259.8kJ•mol-1,该反应的平衡常数的表达式为)
$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$..
(2)等物质的量的CO和H2在一定条件下可合成CH3OCH3,同时还产生了一种可参与大气循环的无机化合物,该反应的化学方程式为:3CO+3H2═CH3OCH3+CO2.
(3)二甲醚燃料电池原理如图1所示

①M区发生的电极反应式为CH3OCH3+3H2O-12e-=2CO2+12H+.
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗CH3OCH3的质量为0.24g(假设溶液电解前后体积不变,保留2位有效数字).
Ⅱ.硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1
(1)下列说法中可以说明该反应已达到平衡状态的是bd
a.体系内混合气体的密度保持不变 h.v(NO2)正=v(SO3)逆
c.容器内气体的总压强保持不变 d.NO体积分数不再改变
(2)某温度下,NO2(g)+SO2(g)?SO3(g)+NO(g)的平衡常数K=$\frac{9}{4}$,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如表所示,
| 起始浓度 | 甲 | 乙 | 丙 |
| c(NO2)/mol•L-1 | 0.10 | 0.20 | 0.20 |
| c(SO2)/mol•L-1 | 0.10 | 0.10 | 0.20 |
②丙达到平衡所用的时间<10min(填“<”“>”“=”),达到平衡后,设甲、乙、丙中SO2(g)的转化率分别为a、b、c,则三者的大小关系为a=c<b.