题目内容
已知1 mol SO2(g)完全转化为1 mol SO3(g)放热99 kJ.2SO2(g)+O2(g)![]() 2SO3(g) ΔH=a kJ·mol-1,反应过程的能量变化如图所示.请回答:
2SO3(g) ΔH=a kJ·mol-1,反应过程的能量变化如图所示.请回答:
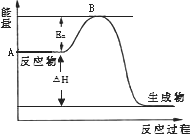
(1)图中ΔH=________.
(2)该反应常用V2O5作催化剂,加入V2O5会使图中Ea________ΔH________(两空均填“升高”、“降低”或“不变”).
(3)已知单质硫的燃烧热为296 kJ·mol-1,写出反应的热化学方程式:________,常温常压下,由单质硫和氧气经两步反应,生成3 mol SO3(g),放出的总热量为________.
解析:
|
(1)-198 kJ·mol-1(2分) (2)降低 不变(每空1分) (3)S(s)+O2(g) |

 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案(2013?金华模拟)有A、B、C、D四种强电解质,它们在水中电离产生的离子如下表(每种物质只含一种阴离子且互不重复).
①A、C溶液的pH均大于7,A、B溶液中水的电离程度比纯水大; ②C溶液和D溶液混合时只产生白色沉淀,B溶液和C溶液混合时只产生刺激性气味的气体,A溶液和D溶液混合时无明显现象. 有关说法不正确的是( ) |
|
已知Na2SO4和NaCl混合溶液中,Cl-的物质的量浓度是Na+的物质的量浓度的 | |
| [ ] | |
A. |
溶液中一定有1 mol Na2SO4和3 mol NaCl |
B. |
所带电荷数SO |
C. |
SO |
D. |
Na2SO4和NaCl的物质的量之比为1∶3 |
Ⅰ.2011年4月27日某市工商局查获400克袋装中老年补钙营养奶粉1 401包。这种奶粉被鉴定为所含亚硝酸盐残留量高出正常值7.8倍,长期食用可能致癌。已知NaNO2能发生如下反应:2NaNO2+4HI===2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是_____,若有0.75 mol的还原剂被氧化,则被还原的氧化剂有_____mol。
(2)根据上述反应,可以用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①自来水;②淀粉碘化钾试纸;③淀粉;④白糖;⑤食醋;⑥白酒。进行实验时,必须选用的物质有____________。
(3)某工厂废切削液中含有2%~5%的NaNO2,直接排放会造成污染,下列试剂中_____(填序号)能使NaNO2转化为不引起二次污染的N2反应的化学方程式为________________________ (并标出电子转移的数目和方向)。
①NaCl ②NH4Cl ③H2O2 ④浓H2SO4
(4)下列离子在溶液中一定能大量共存的是________。
A.NH Cl- OH- CO Cl- OH- CO | B.Fe2+ NO3- Cl- H+ |
C.CH3COO- NH H+ Cl- H+ Cl- | D.CH3COO- Na+ Cl- SO |
4CuI+Hg===Cu2HgI4+2Cu。
(1)上述反应产物Cu2HgI4中,Cu元素是________价。
(2) CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式:
 Cu2++
Cu2++ I-===
I-=== CuI+
CuI+ I
I