题目内容
4.钠与下列溶液反应既产生气体又产生沉淀的是( )| A. | KCl | B. | Na2SO4 | C. | FeCl3 | D. | BaCl2 |
分析 钠性质活泼,与盐溶液反应时,首先和水反应生成氢氧化钠和氢气,有生成生成,则该沉淀应为难溶于水的碱,以此解答.
解答 解:钠和水反应生成氢氧化钠和氢气,NaOH与KCl、Na2SO4、BaCl2都不反应,没有沉淀生成,与FeCl3反应生成Fe(0H)3沉淀,故选C.
点评 本题考查元素化合物的性质,比较简单,钠与碱、盐的反应中首先考虑与溶液中的水反应,然后再看生成的氢氧化钠能否与碱、盐本身反应.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
14.下列有关物质的性质与用途具有对应关系的是( )
| A. | Al2O3熔点高,可用作耐高温材料 | B. | SiO2能与HF反应,可用作光导纤维 | ||
| C. | KAl(SO4)2易溶于水,可用作净水剂 | D. | Fe2O3能与酸反应,可用作红色涂料 |
15.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | FeCl3溶液中:K+、Na+、SO42-、SCN- | |
| B. | 在强碱性溶液中:K+、Na+、CO3-、AlO2- | |
| C. | 在盐酸溶液中:K+、Fe2+、SO32-、NO3- | |
| D. | 与铝反应产生氢气的溶液中:Na+、K+、HCO3-、Cl- |
12.决定物质性质的重要因素是物质结构.请回答下列问题.
(1)已知A和B为第三周期元素,其原子第一至第四电离如表所示:
A通常显+3价,A的第一电离能小于B的第一电离能的原因.
(2)PCl3的空间构型为,中心原子的杂化类型为sp3杂化.
(3)某化合物的分子结构如图所示,接受孤电子对的成键原子基态的核外电子排布式为.其分子内不含有AC(填字母).

A.离子键 B.极性键 C.金属键 D.配位键 E.氢键 F.非极性键
(4)氮化铝具有耐高温、抗冲击、导热性好等优良性质,氮化硼与氮化铝晶体类型相同,氮化硼的熔点比氮化铝高 (填高或低),可能的原因是氮化硼与氮化铝均为原子晶体,且硼原子半径小于铝原子半径,B-N键键能大于Al-N键键能.
(5)若氮化铝的密度为pgcm-3,则晶体中最近的两个A1原子的距离为$\frac{\sqrt{2}}{2}•\root{3}{\frac{164}{ρ•{N}_{A}}}$cm.(阿伏伽德罗常数的值用NA表示)
(1)已知A和B为第三周期元素,其原子第一至第四电离如表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1 817 | 2 745 | 11 578 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(2)PCl3的空间构型为,中心原子的杂化类型为sp3杂化.
(3)某化合物的分子结构如图所示,接受孤电子对的成键原子基态的核外电子排布式为.其分子内不含有AC(填字母).

A.离子键 B.极性键 C.金属键 D.配位键 E.氢键 F.非极性键
(4)氮化铝具有耐高温、抗冲击、导热性好等优良性质,氮化硼与氮化铝晶体类型相同,氮化硼的熔点比氮化铝高 (填高或低),可能的原因是氮化硼与氮化铝均为原子晶体,且硼原子半径小于铝原子半径,B-N键键能大于Al-N键键能.
(5)若氮化铝的密度为pgcm-3,则晶体中最近的两个A1原子的距离为$\frac{\sqrt{2}}{2}•\root{3}{\frac{164}{ρ•{N}_{A}}}$cm.(阿伏伽德罗常数的值用NA表示)
9.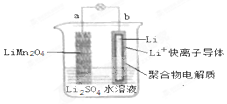 2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,放电时,该电池的反应为 Li1-xMn2O4+xLi=LiMn2O4.则下列叙述错误的是( )
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,放电时,该电池的反应为 Li1-xMn2O4+xLi=LiMn2O4.则下列叙述错误的是( )
 2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,放电时,该电池的反应为 Li1-xMn2O4+xLi=LiMn2O4.则下列叙述错误的是( )
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,放电时,该电池的反应为 Li1-xMn2O4+xLi=LiMn2O4.则下列叙述错误的是( )| A. | a 为电池的正极 | |
| B. | 电池充电反应为 LiMn2O4=Li1-xMn2O4+xLi | |
| C. | 放电时,a 极锂的化合价发生变化 | |
| D. | 放电时,溶液中 Li+从 b 向 a 迁移 |
16.下列实验操作正确且能达到预期目的是( )
| 选项 | 实验目的 | 操作 |
| A | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| B | 验证淀粉已水解 | 向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热 |
| C | 比较Mg和Al的金属活动性强弱 | 分别用镁、铝为电极,氢氧化钠为电解质的原电池装置中反应现象 |
| D | 除去苯中混有的苯酚 | 向混合液中加入过量浓溴水,充分反应后,过滤 |
| A. | A | B. | B | C. | C | D. | D |
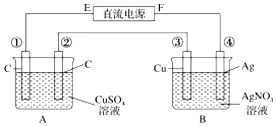 如图所示,通电5min后,第③极增重2.16g,此时CuSO4恰好电解完.设A池中原混合溶液的体积为200mL.
如图所示,通电5min后,第③极增重2.16g,此时CuSO4恰好电解完.设A池中原混合溶液的体积为200mL.