题目内容
已知X、Y、Z、W和T五种短周期主族元素,它们的原子序数依次增大.X原子中的电子只占据一个原子轨道.Y是地壳中含量最多的元素,T是海水中离子浓度最大的元素,W原子的最外层电子数是电子层数的2倍,Z原子的最外层s电子数比内层的s电子数少3个.根据以上信息填空:
(1)W元素的原子核外共有 种不同运动状态的电子;最外层电子排布式为 ,T原子中电子云的形状有 种.
(2)由X、Y、T三种元素形成的化合物A具有漂白性.则A的电子式为 .
(3)Y、Z、W、T的简单离子的半径由大到小的顺序为(用离子符号表示) ;X2Y的沸点 X2W的沸点(填“>”或“<”).
(4)X、Y、W可形成两种带一个负电荷的双核阴离子,请写出两者之间发生反应的离子方程式为 .
(1)W元素的原子核外共有
(2)由X、Y、T三种元素形成的化合物A具有漂白性.则A的电子式为
(3)Y、Z、W、T的简单离子的半径由大到小的顺序为(用离子符号表示)
(4)X、Y、W可形成两种带一个负电荷的双核阴离子,请写出两者之间发生反应的离子方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X原子中的电子只占据一个原子轨道,则X为H元素,Y是地壳中含量最多的元素,则Y为O氧元素,T是海水中离子浓度最大的元素,则T为Cl元素,W原子的最外层电子数是电子层数的2倍,则W为S元素,Z原子的最外层s电子数比内层的s电子数少3个,短周期内层s电子为4个,则Z最外层有1个s电子,Z为Na元素,X、Y、Z、W和T五种元素依次为:H、O、Na、S、Cl元素,根据所推出元素及化合物性质解答.
解答:
解:X原子中的电子只占据一个原子轨道,则X为H元素,Y是地壳中含量最多的元素,则Y为O氧元素,T是海水中离子浓度最大的元素,则T为Cl元素,W原子的最外层电子数是电子层数的2倍,则W为S元素,Z原子的最外层s电子数比内层的s电子数少3个,短周期内层s电子为4个,则Z最外层有1个s电子,Z为Na元素,X、Y、Z、W和T五种元素依次为:H、O、Na、S、Cl元素.
(1)W为S元素,原子核外由16个电子,故有16种运动状态,最外层电子排布为3s23p4,T为Cl元素,能级名称不同,电子云状态不同,Cl原子核外有s、p能级,则有两种不同形状的电子云,故答案为:16;3s23p4;2;
(2)由X、Y、T三种元素形成的化合物A为次氯酸(HClO),O和H、Cl形成两对共有电子对,电子式为: ,故答案为:
,故答案为: ;
;
(3)Y、Z、W、T的简单离子为:O2-、Na+、S2-、Cl-,O2-和Na+电子层结构相同,随核电荷数增多半径减小,故O2->Na+,S2-和Cl-电子层结构相同,随核电荷数增多半径减小,S2->Cl-,电子层数多,半径大,故Y、Z、W、T的简单离子的半径由大到小的顺序为:S2->Cl->O2->Na+;由于H2O分之间形成氢键,故H2O的沸点大于H2S,故答案为:S2->Cl->O2->Na+,>;
(4)H、O、S可形成OH-、HS-,二者反应的离子方程式为:OH-+HS-=S2-+H2O,故答案为:OH-+HS-=S2-+H2O.
(1)W为S元素,原子核外由16个电子,故有16种运动状态,最外层电子排布为3s23p4,T为Cl元素,能级名称不同,电子云状态不同,Cl原子核外有s、p能级,则有两种不同形状的电子云,故答案为:16;3s23p4;2;
(2)由X、Y、T三种元素形成的化合物A为次氯酸(HClO),O和H、Cl形成两对共有电子对,电子式为:
 ,故答案为:
,故答案为: ;
;(3)Y、Z、W、T的简单离子为:O2-、Na+、S2-、Cl-,O2-和Na+电子层结构相同,随核电荷数增多半径减小,故O2->Na+,S2-和Cl-电子层结构相同,随核电荷数增多半径减小,S2->Cl-,电子层数多,半径大,故Y、Z、W、T的简单离子的半径由大到小的顺序为:S2->Cl->O2->Na+;由于H2O分之间形成氢键,故H2O的沸点大于H2S,故答案为:S2->Cl->O2->Na+,>;
(4)H、O、S可形成OH-、HS-,二者反应的离子方程式为:OH-+HS-=S2-+H2O,故答案为:OH-+HS-=S2-+H2O.
点评:本题考查了元素推断及元素及化合物性质,中等难度,推断元素是关键,结合元素周期律解题,注意次氯酸电子式的写法,原子排列不能按化学式的顺序书写.

练习册系列答案
相关题目
下列说法正确的是( )
| A、酸性氧化物一定是非金属氧化物,金属氧化物一定是碱性氧化物 |
| B、氢气中氢元素的化合价为0,所以氢分子中没有化学键 |
| C、离子键只存在于离子化合物中,而共价键可能存在于离子化合物或共价化合物中 |
| D、往饱和NaCl溶液中先通CO2至饱和,再往溶液中通NH3至饱和,可析出大量NaHCO3固体 |
临界状态指的是物质的气态和液态平衡共存时的一个边缘状态,在这种状态下,液体密度和饱和的蒸汽密度相同,因而他们的界面小时,这种状态只能在临界温度和临界压强下实现,可用临界点表示.二氧化硫的临界点为 157℃和78 atm,液态二氧化硫在25℃时的蒸汽压强为3.8 atm.试判断下列说法正确是( )
| A、二氧化硫的正常沸点在 25~157℃之间 |
| B、25℃贮有半满液态二氧化硫容器内的压力为5 atm |
| C、气态二氧化硫在150℃,80 atm时不能液化 |
| D、25℃和1 atm下二氧化硫是气体 |
下列实验操作或实验原理的说法中正确的是( )
A、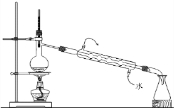 用如图装置进行蒸馏实验 用如图装置进行蒸馏实验 |
B、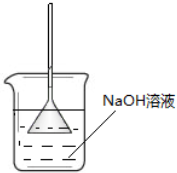 用如图装置吸收氯化氢气体 用如图装置吸收氯化氢气体 |
C、 用酒精提取溴水中的溴 用酒精提取溴水中的溴 |
D、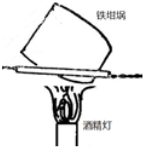 用如图装置灼烧小苏打制取少量的苏打 用如图装置灼烧小苏打制取少量的苏打 |
将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,即构成甲烷燃料电池.已知通入甲烷的一极,其电极反应为:CH4+10OH--8e-=CO32-+7H2O;下列叙述不正确的是( )
| A、通入甲烷的一极为负极 |
| B、通入氧气的一极发生还原反应 |
| C、该电池总反应为:CH4+2O2+2OH-=CO32-+3H2O |
| D、该电池在工作时,溶液中的阴离子向正极移动 |
下列装置或操作能达到实验目的是( )
A、 中和热测定 |
B、 构成原电池 |
C、 收集氢气 |
D、 定容 |
硬水是指( )
| A、含有大量悬浮物的水 |
| B、含有有毒物的污水 |
| C、很臭的废水 |
| D、含有大量Ca2+、Mg2+的水 |
 某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下:
某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下: