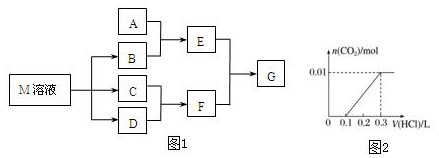
题目内容
18.写出除去下列物质中的杂质(括号内为杂质)时发生反应的化学方程式:(1)Na2CO3固体(NaHCO3)2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(2)SiO2(Al2O3)Al2O3+6HCl=2AlCl3+3H2O.
分析 (1)碳酸氢钠不稳定,加热易分解;
(2)氧化铝为两性氧化物,可与酸反应分离.
解答 解:(1)碳酸氢钠不稳定,加热易分解生成碳酸钠,可除去杂质,反应的方程式为,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(2)二者都可与碱法反应,但氧化铝为两性氧化物,可与酸反应分离,反应的化学方程式为Al2O3+6HCl=2AlCl3+3H2O,故答案为:Al2O3+6HCl=2AlCl3+3H2O.
点评 本题考查物质的分离,为高频考点,侧重于学生的分析能力和实验能力的考查,题目难度不大,做题时注意把握物质的性质和分离的原理.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.人类对赖以生存的地球环境的保护问题越来越重视,如何减少或取代高污染的化学品的使用,一直是许多化学家奋斗的目标,生产和应用绿色化工原料是达到该目标的最有效手段.碳酸二甲酯(简称DMC)是一种新化工原料,2008年在欧洲被誉为“非毒性化学品”.下列关于DMC的说法中正确的是( )
| A. | DMC的结构简式为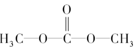 | |
| B. | DMC在空气不能燃烧 | |
| C. | DMC易溶于水,不溶于乙醇和丙酮 | |
| D. | DMC用于生产非毒性化工产品,故被誉为有机合成的“绿色化工原料” |
13.配制0.1摩/升的1000毫升硝酸溶液,需量取1摩/升硝酸100毫升,加水定容时,仰视容量瓶刻度线使凹液面最低处与刻度线有唯一交点时停止加水,并摇匀,此时配得的硝酸溶液的摩尔浓度( )
| A. | >0.1摩/升 | B. | <0.1摩/升 | C. | =0.125摩/升 | D. | 无法确定 |
3.NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,22.4 L CO2中含有NA个CO2分子 | |
| B. | 1.7 g H2O2中含有的电子数为0.9NA | |
| C. | 标准状况下,2.24 L乙醇含有的分子数等于0.1NA | |
| D. | 分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g |
8.有Na2SO4 和 Fe2(SO4)3 的混合溶液,已知其中 Fe3+的物质的量浓度为0.4mol•L-1,SO42-的物质的量浓度为0.7mol•L-1,则此溶液中Na+的物质的量浓度为( )
| A. | 0.1 mol•L-1 | B. | 0.15 mol•L-1 | C. | 0.2 mol•L-1 | D. | 0.25 mol•L-1 |
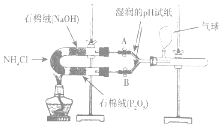 某实验小组利用如图装置验证NH4 C l受热分解时的分解产物为氨气和氯化氢.
某实验小组利用如图装置验证NH4 C l受热分解时的分解产物为氨气和氯化氢.