题目内容
15.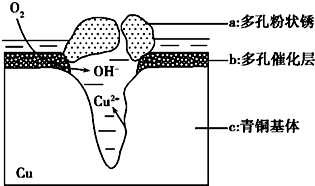 如图1为青铜器在潮湿环境中发生的电化学腐蚀的示意图.
如图1为青铜器在潮湿环境中发生的电化学腐蚀的示意图.(1)腐蚀过程中,负极是c(填图中字母“a”或“b”或“c”;
(2)环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔铜锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;
(3)若生成4.29gCu2(OH)3Cl,则理论上耗氧体积为0.448L(标准状况).
分析 (1)根据图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,则Cu作负极;
(2)Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀;
(3)n[Cu2(OH)3Cl]=$\frac{4.29g}{214.5g/mol}$=0.05mol,根据转移电子计算氧气物质的量,再根据V=nVm计算体积.
解答 解:(1)根据图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,则Cu作负极,即c是负极,
故答案为:c;
(2)Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀,离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓,
故答案为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;
(3)n[Cu2(OH)3Cl]=$\frac{4.29g}{214.5g/mol}$=0.02mol,根据转移电子得n(O2)=$\frac{0.02mol×2×2}{4}$=0.02mol,V(O2)=0.02mol×22.4L/mol=0.448L,
故答案为:0.448.
点评 本题考查的原电池原理的应用、物质的量的有关计算,题目难度中等,侧重于考查学生对基本原理的应用能力和计算能力.

练习册系列答案
相关题目
3.下列说法中正确的是( )
| A. | 1mol任何气体的体积约是22.4L | |
| B. | 标准状况下,1mol H2O 所占的体积约为22.4L | |
| C. | 常温常压下,1mol O2 所占的体积约为22.4L | |
| D. | 标准状况下,体积为22.4LN2 和N2O 的混合气体,其中约含有2mol N 原子 |
10.下列说法正确的是( )
| A. | H2O和H2O2中的化学键类型完全相同 | |
| B. | N2的结构式为N-N | |
| C. | 一个D216O分子所含的中子数为10 | |
| D. | 二氧化碳 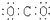 |
20.下列物质按纯净物、混合物、电解质、非电解质的顺序排列的一组为( )
| A. | 纯盐酸、空气、硫酸、干冰 | B. | 蒸馏水、氨水、碳酸氢钠、二氧化硫 | ||
| C. | 胆矾、盐酸、铁、碳酸钙 | D. | 生石灰、浓硫酸、氯化铜、碳酸钠 |
7.下列四种演示金属钾与水反应的实验装置,正确的是( )
| A. |  | B. |  | C. |  | D. |  |
4.下列有关物质性质的应用正确的是( )
①浓硝酸见光易分解,需储存在棕色试剂瓶
②二氧化碳是酸性氧化物,通入氯化钙溶液中有白色沉淀生成.
③一氧化氮和二氧化氮都是造成光化学烟雾的主要气体
④一氧化碳有剧毒,不可以用来冶炼金属铁.
①浓硝酸见光易分解,需储存在棕色试剂瓶
②二氧化碳是酸性氧化物,通入氯化钙溶液中有白色沉淀生成.
③一氧化氮和二氧化氮都是造成光化学烟雾的主要气体
④一氧化碳有剧毒,不可以用来冶炼金属铁.
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
5.下列离子方程式书写正确的是( )
| A. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 硫酸氢钠溶液中加入足量的烧碱溶液:H++SO42-+OH-═SO42-+H2O | |
| C. | 过氧化钠与水反应:2O2-+2H2O═4OH-+O2↑ | |
| D. | 澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2═Ca2CO3↓+H2O |

