题目内容
下列各表述与示意图一致的是


| A、图①中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)+Q使用和未使用催化剂时,反应过程中的能量变化 |
| B、图②表示25℃时,用0.1mol?L-1盐酸滴定20mL 0.1mol?L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
| C、图③表示锌粒与过量稀盐酸反应时,V(H2) 随时间的变化图 |
| D、图④中曲线表示反应2SO2(g)+O2(g)=2SO3(g)+Q 正、逆反应的平衡常数K随温度的变化 |
考点:反应热和焓变,化学反应速率的影响因素,化学平衡的影响因素,酸碱混合时的定性判断及有关ph的计算
专题:图示题
分析:A、因该反应是放热反应,应反应物的总能量大于生成物的总能量;
B、盐酸滴定氢氧化钠,PH先下降后突变;
C、随着反应的进行,氢离子浓度逐渐减小,放出氢气的速率逐渐减小;
D、因反应为放热反应,则升高温度,平衡逆向移动,平衡后升温K逆减小,而K正增大,且正逆反应的平衡常数互为倒数关系.
B、盐酸滴定氢氧化钠,PH先下降后突变;
C、随着反应的进行,氢离子浓度逐渐减小,放出氢气的速率逐渐减小;
D、因反应为放热反应,则升高温度,平衡逆向移动,平衡后升温K逆减小,而K正增大,且正逆反应的平衡常数互为倒数关系.
解答:
解:A、图象a活化能减小,a使用了催化剂,因该反应是放热反应,应反应物的总能量大于生成物的总能量,但图象描述是吸热反应,故A错误;
B、盐酸滴定氢氧化钠,PH先下降后突变,与图象一致,故B正确;
C、随着反应的进行,氢离子浓度逐渐减小,放出氢气的速率逐渐减小,图象应为一平滑的曲线,故C错误;
D、因反应为放热反应,则升高温度,平衡逆向移动,平衡后升温K逆减小,而K正增大,且正逆反应的平衡常数互为倒数关系,故D正确;
故选BD.
B、盐酸滴定氢氧化钠,PH先下降后突变,与图象一致,故B正确;
C、随着反应的进行,氢离子浓度逐渐减小,放出氢气的速率逐渐减小,图象应为一平滑的曲线,故C错误;
D、因反应为放热反应,则升高温度,平衡逆向移动,平衡后升温K逆减小,而K正增大,且正逆反应的平衡常数互为倒数关系,故D正确;
故选BD.
点评:本题以图象与中和滴定、化学平衡、氧化还原反应、反应中的能量变化来考查学生,这些知识点是新课程改革考查的重点,明确考点“形变神不变”,做到善于抓规律、编网络来掌握即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列实验设计及其对应的方程式均正确的是( )
| A、将铜片加入到FeCl3溶液中,观察溶液颜色的变化,证明微粒的氧化性Fe3+>Cu2+:Cu+2Fe3+=Cu2++2Fe2+ |
| B、测定0.1mol/LH3PO4溶液的pH>1证明H3PO4为弱酸:H3PO4?3H++PO43ˉ |
| C、实验室用Na2O2与H2O反应,快速制备O2:Na2O2+H2O=2Na++2OH-+O2↑ |
| D、向Na2CO3溶液中滴入甲基橙溶液,溶液变黄,证明Na2CO3溶液显碱性:CO32ˉ+H2O?HCO3ˉ+OHˉ |
下列实验与对应示意图的关系正确的是( )
A、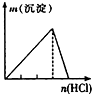 NaAlO2溶液中逐滴滴加稀盐酸至过量 |
B、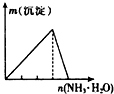 AlCl3溶液中逐滴滴加氨水至过量 |
C、 明矾溶液中逐滴滴加Ba(OH)2至过量 |
D、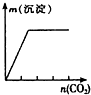 澄清石灰水中缓慢通入CO2至过量 |
下列说法中正确的是( )
| A、煤燃烧是化学能转化为光能的过程 |
| B、1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
| C、HCl和NaOH反应的中和热△H=-57.3 kJ?mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ?mol-1 |
| D、反应H2(g)+F2(g)═2HF(g);△H=-270 kJ?mol-1,说明在相同条件下,1 mol氢气与1 mol氟气的能量总和大于2 mol氟化氢气体的能量 |
下列溶液中Cl-浓度最小的是( )
| A、200mL 2mol/L MgCl2溶液 |
| B、500mL 2mol/L NaCl溶液 |
| C、300mL 5mol/L KCl溶液 |
| D、400mL 1mol/L AlCl3溶液 |
 硝酸钾和氯化钾的溶解度曲线如图所示,下列叙述正确的是( )
硝酸钾和氯化钾的溶解度曲线如图所示,下列叙述正确的是( )| A、硝酸钾的溶解度一定大于氯化钾的溶解度 |
| B、降低温度可使接近饱和的硝酸钾溶液变饱和 |
| C、t℃时,硝酸钾和氯化钾两种溶液的溶质质量分数一定相等 |
| D、60℃时,100 g水中加入90 g硝酸钾,充分搅拌,可得到硝酸钾的饱和溶液 |
下列有关“焰色反应”说法中正确的是( )
| A、非金属单质燃烧时火焰均为无色 |
| B、所有金属及其化合物灼烧时火焰均有颜色 |
| C、NaCl与Na2CO3灼烧时火焰颜色相同 |
| D、焰色反应均应透过蓝色钴玻璃观察 |
 如图为干冰及其晶体的结构模型,下列有关分析正确的是( )
如图为干冰及其晶体的结构模型,下列有关分析正确的是( )| A、构成干冰的微粒是C原子和O原子 |
| B、CO2为极性分子 |
| C、干冰溶于水时有共价键要生成 |
| D、干冰中只存在微弱的分子间作用力 |