题目内容
【题目】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
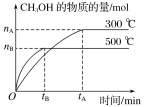
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)ΔH。
2CO(g)+2H2(g)ΔH。
已知:C(s)+2H2(g)=CH4(g)ΔH=-75kJ·mol1
C(s)+O2(g)=CO2(g)ΔH=-394kJ·mol1
C(s)+![]() O2(g)=CO(g)ΔH=-111kJ·mol1
O2(g)=CO(g)ΔH=-111kJ·mol1
该催化重整反应的ΔH=________kJ·mol1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压B.低温高压C.高温高压D.低温低压
某温度下,在体积为2L的容器中加入2molCH4、1molCO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为___________________________。
素材1:研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。总反应为:2Li+2H2O===2LiOH+H2↑。根据以上素材回答下列问题:
(2)该电池的负极是________,负极反应式是_____________________________。
(3)正极现象是_______________________________________________。
(4)放电时OH-向_____________(填“正极”或“负极”)移动。
【答案】247 A ![]() 锂或Li Li-e-===Li+ 有无色气体产生 负极
锂或Li Li-e-===Li+ 有无色气体产生 负极
【解析】
(1)根据盖斯定律解题,结合影响平衡的因素分析判断,根据平衡状态计算平衡常数;
(2)金属锂比钢板(主要成分为铁)活泼,作原电池的负极;LiOH溶液中的阳离子有Li+和H+,由于氧化性H+>Li+,正极上是水电离出的H+放电;在原电池的放电过程中阳离子向正极移动,阴离子向负极移动分析解答。
(1)①C(s)+2H2(g)═CH4(g)△H=-75kJmol-1,②C(s)+O2(g)═CO2(g)△H=-394kJmol-1,③2C(s)+O2(g)═2CO(g)△H=-222kJmol-1,根据盖斯定律,将方程式③-①-②得CH4(g)+CO2(g)═2CO(g)+2H2(g),△H=(-222+75+394)kJ/mol=+247kJ/mol,该反应的正反应是反应前后气体体积增大的吸热反应,要使甲烷的转化率增大,可以通过减小压强、升高温度实现,故答案为A;
开始时c(CH4)=![]() mol/L=1mol/L、c(CO2)=
mol/L=1mol/L、c(CO2)=![]() mol/L=0.5mol/L,达到平衡时CO2的转化率是50%,则消耗c(CO2)=0.5mol/L×50%=0.25mol/L;
mol/L=0.5mol/L,达到平衡时CO2的转化率是50%,则消耗c(CO2)=0.5mol/L×50%=0.25mol/L;

其平衡常数= ;
;
(2)金属锂比钢板活泼,作原电池的负极,电极反应式为Li-e-=Li+;
(3)LiOH溶液中的阳离子有Li+和H+,由于氧化性H+>Li+,正极上是水电离出的H+放电,故正极反应式为:2H2O+2e-=H2↑+2OH-,正极产生无色气体;
(4)在原电池的放电过程中阳离子向正极移动,阴离子向负极移动,所以OH-会向负极移动。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
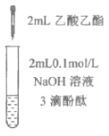
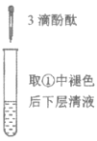
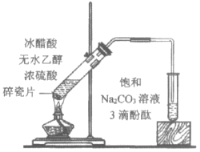
三点一测快乐周计划系列答案【题目】下列实验所得结论正确的是
① | ② | ③ | ④ |
|
|
|
|
充分振荡试管,下层溶液红色褪去 | 溶液变红 | 溶液变红 | 充分振荡右侧小试管, 下层溶液红色褪去 |
A.①中溶液红色褪去的原因是:CH3COOC2H5+NaOH![]() CH3COONa+C2H5OH
CH3COONa+C2H5OH
B.②中溶液变红的原因是:CH3COO-+H2O![]() CH3COOH+H+
CH3COOH+H+
C.由实验①、②、③推测,①中红色褪去的原因是乙酸乙酯萃取了酚酞
D.④中红色褪去证明右侧小试管中收集到的乙酸乙酯中混有乙酸