题目内容
【题目】Ⅰ.实验室欲用质量分数为36.5%的浓盐酸(密度为![]() )来配制
)来配制![]() 稀盐酸。请回答下列问题:
稀盐酸。请回答下列问题:
(1)需要用到的仪器除量筒烧杯外,还需用到的仪器有_________。
(2)在上述仪器选定的情况下,需要量取浓盐酸________![]() 。
。
(3)对于容量瓶来说除洗净外还必须进行的一项操作是_____________。
(4)配制溶液过程中,下列操作对溶液中溶质的物质的量浓度有何影响?(在横线上填“偏高”“偏低”或“无影响”)
①烧杯和玻璃棒洗净后没有烘干即进行实验:________________。
②溶解液转移后没有用蒸馏水洗涤烧杯2~3次:________________。
③定容时,俯视刻度线:__________________。
Ⅱ.取出配制好的盐酸![]() 与足量的锌粒反应。试计算:
与足量的锌粒反应。试计算:
(5)产生的氢气在标准状况下的体积为_________![]() 。
。
(6)转移的电子的物质的量为__________。
【答案】胶头滴管、![]() 容量瓶、玻璃棒 25.0 检查是否漏液 无影响 偏低 偏高 134.4
容量瓶、玻璃棒 25.0 检查是否漏液 无影响 偏低 偏高 134.4 ![]()
【解析】
Ⅰ.(1)配制一定物质的量浓度的溶液需要用到的仪器是量筒(天平)、烧杯、一定规格的容量瓶、胶头滴管、玻璃棒,故答案为:胶头滴管、![]() 容量瓶、玻璃棒;
容量瓶、玻璃棒;
(2)![]() 稀盐酸的物质的量为
稀盐酸的物质的量为![]() ,
,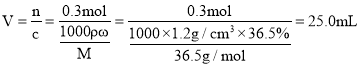 ,故答案为:
,故答案为:![]() ;
;
(3)容量瓶使用前必须检验是否漏液,故答案为:检查是否漏液;
(4)①烧杯和玻璃棒洗净后没有烘干对实验无影响,故答案为:无影响;
②溶解液转移后没有用蒸馏水洗涤烧杯2~3次,导致溶质物质的量减小,所配溶液的浓度偏低,故答案为:偏低;
③定容时,俯视刻度线,体积偏小,所配溶液的浓度偏高,故答案为:偏高;
Ⅱ.(5)![]() 盐酸的物质的量为
盐酸的物质的量为![]() ,根据反应方程式:
,根据反应方程式:![]() ↑,所生成的氢气的物质的量为
↑,所生成的氢气的物质的量为![]() ,
,![]() ,故答案为:134.4;
,故答案为:134.4;
(6)生成![]() ,转移
,转移![]() ,则生成
,则生成![]() ,转移
,转移![]() ,故答案为:
,故答案为:![]() 。
。

【题目】掌握化学的基本概念和研究方法才能学好化学。按要求回答下列问题:
(1)下列是对碱、酸、盐、氧化物的分类列表:
碱 | 酸 | 盐 | 氧化物 | |
第一组 |
|
|
|
|
第二组 |
|
|
|
|
第三组 |
|
|
|
|
表中每组均有物质分类错误,三组中对应分类错误的物质分别是_________、_________、_________。(填化学式)
(2)![]() 固体不能导电,而
固体不能导电,而![]() 溶液可以导电,原因是_________________________。
溶液可以导电,原因是_________________________。
(3)依据下列两个反应,按要求填空。
Ⅰ.![]()
Ⅱ.![]()
反应Ⅰ和反应Ⅱ中,![]() 只作氧化剂的反应是________(填“Ⅰ”或“Ⅱ”);反应Ⅱ中,每生成标准状况下
只作氧化剂的反应是________(填“Ⅰ”或“Ⅱ”);反应Ⅱ中,每生成标准状况下![]() ,反应中转移________
,反应中转移________![]() 电子;
电子;![]() 和
和![]() 都能使澄清石灰水变浑浊,请设计一种方法检验
都能使澄清石灰水变浑浊,请设计一种方法检验![]() 、
、![]() 混合气体中的
混合气体中的![]() :_____________。
:_____________。