题目内容
 非血红素铁是食物中的铁存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.
非血红素铁是食物中的铁存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.(1)Fe2+基态核外电子排布式为
(2)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的一种分子为
(3)蛋白质分子中氨基氮原子的轨道杂化类型是
(4)把氯气通入黄血盐(K4|Fe(CN)6|)溶液中,得到赤血盐(K3|Fe(CN)6|),写出该变化的化学方程式
(5)FeO晶胞结构如图所示,FeO晶体中Fe2+配位数为
考点:原子核外电子排布,配合物的成键情况,“等电子原理”的应用,原子轨道杂化方式及杂化类型判断
专题:
分析:(1)铁是26号元素,其原子核外有26个电子,铁原子失去2个电子变成Fe2+,根据构造原理书写Fe2+核外电子排布式;
(2)原子个数相等且价电子数相等的分子或离子为等电子体;
(3)根据价层电子对互斥理论确定分子空间构型和原子的杂化方式;乙酸分子中含有3个碳氢键、1个碳碳键、2个碳氧键和1个氧氢键;
(4)氯气将+2价的铁氧化成+3价的铁,根据电子得失守恒书写化学方程式;
(6)以亚铁离子为中心,沿X、Y、Z三轴进行切割,从而确定亚铁离子配位数.
(2)原子个数相等且价电子数相等的分子或离子为等电子体;
(3)根据价层电子对互斥理论确定分子空间构型和原子的杂化方式;乙酸分子中含有3个碳氢键、1个碳碳键、2个碳氧键和1个氧氢键;
(4)氯气将+2价的铁氧化成+3价的铁,根据电子得失守恒书写化学方程式;
(6)以亚铁离子为中心,沿X、Y、Z三轴进行切割,从而确定亚铁离子配位数.
解答:
解:(1)铁是26号元素,其原子核外有26个电子,铁原子失去最外层2个电子变成Fe2+,根据构造原理知,其基态离子核外电子排布式为1s22s22p63s23p63d6 或[Ar]3d6 ,故答案为:1s22s22p63s23p63d6 或[Ar]3d6 ;
(2)SCN-中含有3个原子,且其价电子数是16,与SCN-互为等电子体的一种分子为CO2、N2O、CS2、COS等,故答案为:CO2、N2O、CS2、COS;
(3)氮原子含有3个共价键和一个孤电子对,N原子轨道的杂化类型是sp3,乙酸分子中含有3个碳氢键、1个碳碳键、2个碳氧键和1个氧氢键,所以1mol乙酸分子中含有的σ键的数目7NA,故答案为:sp3;7NA;
(4)氯气将+2价的铁氧化成+3价的铁,所以反应方程式为:2K4[Fe(CN)6]+Cl2=2K3[Fe(CN)6]+2KCl,故答案为:2K4[Fe(CN)6]+Cl2=2K3[Fe(CN)6]+2KCl;
(5)以亚铁离子为中心,沿X、Y、Z三轴进行切割,结合图片知,亚铁离子配位数为6,故答案为:6.
(2)SCN-中含有3个原子,且其价电子数是16,与SCN-互为等电子体的一种分子为CO2、N2O、CS2、COS等,故答案为:CO2、N2O、CS2、COS;
(3)氮原子含有3个共价键和一个孤电子对,N原子轨道的杂化类型是sp3,乙酸分子中含有3个碳氢键、1个碳碳键、2个碳氧键和1个氧氢键,所以1mol乙酸分子中含有的σ键的数目7NA,故答案为:sp3;7NA;
(4)氯气将+2价的铁氧化成+3价的铁,所以反应方程式为:2K4[Fe(CN)6]+Cl2=2K3[Fe(CN)6]+2KCl,故答案为:2K4[Fe(CN)6]+Cl2=2K3[Fe(CN)6]+2KCl;
(5)以亚铁离子为中心,沿X、Y、Z三轴进行切割,结合图片知,亚铁离子配位数为6,故答案为:6.
点评:本题考查较综合,涉及电子排布式的书写、杂化方式的判断、配位数的计算等知识点,难点是配位数的计算,同时考查学生空间想象能力,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
当光束通过下列分散系时,可观察到丁达尔效应的是( )
| A、NaCl溶液 |
| B、H2SO4溶液 |
| C、CuSO4溶液 |
| D、Fe(OH)3胶体 |
有机物CH3CH=CH-Cl能发生的反应有 ①取代反应 ②加成反应 ③消去反应 ④使溴的四氯化碳溶液褪色 ⑤聚合反应 ⑥使酸性高锰酸钾溶液褪色( )
| A、全部 | B、除⑤外 |
| C、除①外 | D、除①、⑤外 |
下列物质不属于合金的是( )
| A、水银 | B、青铜 | C、生铁 | D、碳素钢 |
下列有关环境问题的说法错误的是( )
| A、用天然气代替含硫的煤作燃料,可减少废气中二氧化硫的量 |
| B、臭氧含量过高的空气不利于人体健康 |
| C、溶有大量二氧化碳的降水通常称为酸雨 |
| D、废电池必须回收处理的原因是防止重金属离子污染环境 |
乙烯是一种重要的化工原料,下列有关乙烯的说法中正确的是( )
| A、乙烯和苯的分子结构均含有碳碳双键 |
B、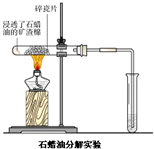 如图石蜡油分解产生的气体只有乙烯,能使溴的CCl4溶液褪色 |
| C、乙烯的产量可以用来衡量一个国家的石油化工生产水平 |
| D、工业常用乙烯与水发生加成反应生产食用酒精 |
如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )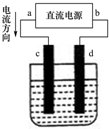

| A、电解过程中,d电极质量增加 |
| B、d为阳极,电极反应为:2Cl--2e-=Cl2↑ |
| C、a为负极、b为正极 |
| D、电解过程中,氯离子浓度不变 |
 X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下: