题目内容
2. 下列各组物质中,不满足如图所示转化关系的是( )
下列各组物质中,不满足如图所示转化关系的是( )| 选项 | 甲 | 乙 | 丙 | 戊 |
| A | NH3 | Cl2 | N2 | H2 |
| B | Fe | H2O | Fe2O3 | CO |
| C | Al(OH)3 | NaOH | NaAlO2 | CO2 |
| D | Br2 | FeCl2 | FeBr3 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据反应甲+乙→丙+丁,丙+戊→甲分析,将四个选项中的各物质代入,结合物质的性质判断这两个反应是否能发生,如果能发生,则正确,否则错误.
解答 解:A.8NH3+3Cl2═6NH4Cl+N2,3H2+N2?2NH3,能实现转化,故A不选;
B.3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,Fe和H2O不能反应得到Fe2O3,所以不能实现转化,故B选;
C.Al2O3+2NaOH=2NaAlO2+H2O,NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3 ,所以能实现转化,故C不选;
D.3Br2+6FeCl2=2FeBr3+4FeCl3,氯气氧化性强于溴,能氧化FeBr3中的溴为Br2单质,3Cl2+2FeBr3=3Br2+2FeCl3,所以能实现转化,故D不选;
故选B.
点评 本题考查物质之间的化学反应,明确物质的性质是解本题关键,注意Fe和H2O不能反应得到Fe2O3,为易错点,题目难度不大.

练习册系列答案
相关题目
12.下列反应的离子方程式正确的是( )
| A. | 铜放入稀硫酸中:Cu+2H+═Cu2++H2↑ | |
| B. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ | |
| C. | 金属铁溶于稀硫酸中:2Fe+6 H+═2 Fe3++3 H2↑ | |
| D. | 向硫酸溶液中加入氢氧化钡溶液:SO42++Ba2+═BaSO4↓ |
10.短周期元素X、Y、Z、W、Q在周期表中相对位置如图,其中元素X是地壳中含量最高的元素,下列说法正确的是( )
| X | Y | ||
| Z | W | Q |
| A. | 阴离子的还原性:W2-<Q-<Y- | |
| B. | 常温下,X2与W的单质间化合反应不能自发进行 | |
| C. | ZX2是两性氧化物 | |
| D. | Y的氢化物可用来篆刻玻璃 |
5.运用化学反应原理研究碳、氮、硫等单质及其化合物的反应有重要的意义.
(1)CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:
2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(g)△H=QkJ/mol (Q>0)
在密闭容器中,按CO2与H2的物质的量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图1所示.
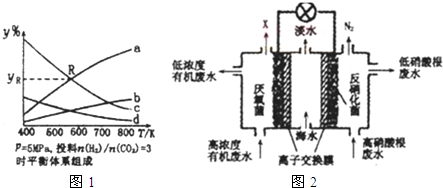
完成下列填空:
①图中曲线a表示的是H2O的体积分数.
②图中曲线a和c的交点R对应物质的体积分数yR=37.5%.
(2)25° C,H2SO3和H2CO3两种酸的电离平衡常数如表.
将足量的NaHSO溶液加人到Na2CO3溶液中,反应的离子方程式为CO32-+HSO3-=HCO3-+SO32-
(3)工业上用可溶性碳酸盐提取锶时,先将SrSO4转化为难溶弱酸盐,再处理.
SrSO4?Sr2+(aq)+SO${\;}_{4}^{2-}$(aq) Ksp=2.5×10-7
SrCO3?Sr2+(aq)+CO${\;}_{3}^{2-}$(aq) Ksp=2.5×10-9
则SrSO4转化为SrCO3反应的平衡常数值为100
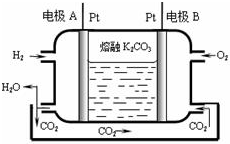
(4)图2是一种三室微生物燃料电池污水净化系统原理示意图,同时处理有机废水和硝酸盐废水,并获得淡水,图中有机废水中有机物可用C6H10O5表示.
①产生N2的电极为电池的正极(填“正”或“负”).
②生成X(气体)的电极上发生的电极反应式为C6H10O5-24e-+7H2O═6CO2↑+24H+.
(1)CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:
2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(g)△H=QkJ/mol (Q>0)
在密闭容器中,按CO2与H2的物质的量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图1所示.

完成下列填空:
①图中曲线a表示的是H2O的体积分数.
②图中曲线a和c的交点R对应物质的体积分数yR=37.5%.
(2)25° C,H2SO3和H2CO3两种酸的电离平衡常数如表.
| K1 | K2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.4×10-7 | 4.7×10-11 |
(3)工业上用可溶性碳酸盐提取锶时,先将SrSO4转化为难溶弱酸盐,再处理.
SrSO4?Sr2+(aq)+SO${\;}_{4}^{2-}$(aq) Ksp=2.5×10-7
SrCO3?Sr2+(aq)+CO${\;}_{3}^{2-}$(aq) Ksp=2.5×10-9
则SrSO4转化为SrCO3反应的平衡常数值为100
(4)图2是一种三室微生物燃料电池污水净化系统原理示意图,同时处理有机废水和硝酸盐废水,并获得淡水,图中有机废水中有机物可用C6H10O5表示.
①产生N2的电极为电池的正极(填“正”或“负”).
②生成X(气体)的电极上发生的电极反应式为C6H10O5-24e-+7H2O═6CO2↑+24H+.
2. 碳及其化合物应用广泛.
碳及其化合物应用广泛.
I.工业上利用CO和水蒸汽反应制氢气,存在以下平衡:
CO(g)+H2O(g)$\stackrel{沸石分子筛}{?}$CO2(g)+H2(g)
(1)沸石分子筛中含有硅元素,请写出硅原子结构示意图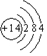 (2)向1L恒容密闭容器中注人CO和H2O(g),830℃时测得部分数据如表.
(2)向1L恒容密闭容器中注人CO和H2O(g),830℃时测得部分数据如表.
则该温度下反应的平衡常数K=1
(3)相同条件下,向1L恒容密闭容器中,同时注人1m o l CO、1mol H2O (g),2molCO2和2mo1H2,此时v(正 )< v(逆)(填“>”“=”或“<”)
II.已知CO(g)+$\frac{1}{2}$O2 (g)= CO2 (g)△H=-141kJ•mol-1
2H2 (g)+O2(g)= 2H2o (g)△H=-484kJ•mol-1
CH3OH(1)+$\frac{3}{2}$O2(g)=CO2 (g)+2H2O (g)△H=-726kJ•mol-1'
(4)利用CO、H2化合制得液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l)△H=+101kJ/mol
III.一种新型氢氧燃料电池工作原理如图所示
(5)写出电极A的电极反应式H2-2e-+CO32-=CO2+H2O
(6)以上述电池电解饱和食盐水,若生成0.2mo1 Cl2,则至少需通入O2的体积为2.24L(标准状况)
 碳及其化合物应用广泛.
碳及其化合物应用广泛.I.工业上利用CO和水蒸汽反应制氢气,存在以下平衡:
CO(g)+H2O(g)$\stackrel{沸石分子筛}{?}$CO2(g)+H2(g)
(1)沸石分子筛中含有硅元素,请写出硅原子结构示意图
 (2)向1L恒容密闭容器中注人CO和H2O(g),830℃时测得部分数据如表.
(2)向1L恒容密闭容器中注人CO和H2O(g),830℃时测得部分数据如表.| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO)/mol | 0.200 | 0.160 | 0.125 | 0.099 | 0.080 | 0.080 |
| n(H2O)/mol | 0.300 | 0.260 | 0.225 | 0.199 | 0.180 | 0.180 |
(3)相同条件下,向1L恒容密闭容器中,同时注人1m o l CO、1mol H2O (g),2molCO2和2mo1H2,此时v(正 )< v(逆)(填“>”“=”或“<”)
II.已知CO(g)+$\frac{1}{2}$O2 (g)= CO2 (g)△H=-141kJ•mol-1
2H2 (g)+O2(g)= 2H2o (g)△H=-484kJ•mol-1
CH3OH(1)+$\frac{3}{2}$O2(g)=CO2 (g)+2H2O (g)△H=-726kJ•mol-1'
(4)利用CO、H2化合制得液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l)△H=+101kJ/mol
III.一种新型氢氧燃料电池工作原理如图所示
(5)写出电极A的电极反应式H2-2e-+CO32-=CO2+H2O
(6)以上述电池电解饱和食盐水,若生成0.2mo1 Cl2,则至少需通入O2的体积为2.24L(标准状况)
3.盛装下列溶液的试剂瓶使用橡胶塞的是( )
| A. | 硫酸 | B. | NaOH溶液 | C. | 盐酸 | D. | NaCl溶液 |

 ,现有相对分子质量最小的该原料的同系物X,检验X中碳碳双键的操作方法取试样X于试管中,加入足量新制氢氧化铜悬浊液加热,出现砖红色沉淀后取上清液滴加适量稀硫酸,再加入溴水,若溴水褪色,说明X中含有碳碳双键,写出X与银氨溶液发生的离子反应方程式CH2=CHCHO+2Ag(NH3)2++2OH-$\stackrel{△}{→}$CH2CHCOO-+NH4++2Ag↓+3NH3+H2O.
,现有相对分子质量最小的该原料的同系物X,检验X中碳碳双键的操作方法取试样X于试管中,加入足量新制氢氧化铜悬浊液加热,出现砖红色沉淀后取上清液滴加适量稀硫酸,再加入溴水,若溴水褪色,说明X中含有碳碳双键,写出X与银氨溶液发生的离子反应方程式CH2=CHCHO+2Ag(NH3)2++2OH-$\stackrel{△}{→}$CH2CHCOO-+NH4++2Ag↓+3NH3+H2O.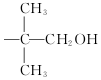 基团;
基团;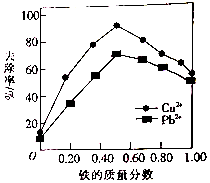 铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物.在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示.已知活性炭对重金属离子具有一定的吸附作用.
铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物.在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示.已知活性炭对重金属离子具有一定的吸附作用.