题目内容
11.有机物A的分子式为C3H6O2,水解后得到一元酸M和一元醇N,下列叙述中不正确的是( )| A. | N、M均不能发生银镜反应 | B. | M中可能没有甲基 | ||
| C. | N可发生消去反应 | D. | N分子中含有甲基 |
分析 C3H6O2水解后得到一元酸M和一元醇N,可能情况有:甲酸乙酯、乙酸甲酯;甲酸乙酯水解生成甲酸和乙醇;乙酸甲酯水解生成乙酸和甲醇,以此来解答.
解答 解:A.若A为甲酸乙酯,则水解生成甲酸可发生银镜反应,故A错误;
B.A为甲酸乙酯,则水解生成甲酸不含甲基,故B正确;
C.若A为甲酸乙酯,水解生成甲酸和乙醇,乙醇可发生消去反应,故C正确;
D.A水解生成乙醇或甲醇,均含甲基,故D正确;
故选A.
点评 本题考查有机物的推断,为高频考点,把握酯的水解、有机物的结构与性质为解答的关键,侧重分析与应用能力的考查,注意A为酯及其同类别的同分异构体,题目难度不大.

练习册系列答案
相关题目
2.已知25℃时部分弱电解质的电离平衡常数数据如表所示:
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液:
a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3
pH由小到大排列的顺序是a<d<c<b(用字母编号填写).
(2)常温下,0.1mol•L-1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD(填字母).
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-) D.c(OH-)/c(H+)
E.c(H+)•c(CH3COO-)/c(CH3COOH)
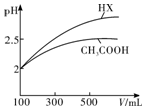
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数.
(4)标准状况下,将1.12L CO2通入100mL 1mol•L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c(OH-)=2c(H2CO3)+c(H+)+c(HCO3-);
②c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-).
(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(填精确值).
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡 常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的四种溶液:
a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3
pH由小到大排列的顺序是a<d<c<b(用字母编号填写).
(2)常温下,0.1mol•L-1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD(填字母).
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-) D.c(OH-)/c(H+)
E.c(H+)•c(CH3COO-)/c(CH3COOH)
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数.

(4)标准状况下,将1.12L CO2通入100mL 1mol•L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c(OH-)=2c(H2CO3)+c(H+)+c(HCO3-);
②c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-).
(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(填精确值).
2.某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1:5,则Cl2与NaOH溶液反应时被氧化的氯原子与被还原的氯原子的物质的量之比为( )
| A. | 1:1 | B. | 5:1 | C. | 3:13 | D. | 4:15 |
19.根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )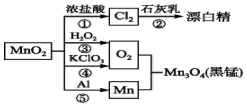

| A. | 反应①②③④⑤均属于氧化还原反应,反应③还属于置换反应 | |
| B. | 反应⑤说明该条件下铝可用于制熔点较高的金属 | |
| C. | 相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1 | |
| D. | 反应①中氧化剂与还原剂的物质的量之比为1:4 |
3.下列有关电解质溶液的说法正确的是( )
| A. | 向盐酸中加入氨水至中性,溶液中$\frac{c(N{H}_{4}^{+})}{c(C{l}^{-})}$<1 | |
| B. | 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中$\frac{c(C{l}^{-})}{c(B{r}^{-})}$变大 | |
| C. | 将CH3COONa溶液加入水稀释后,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 | |
| D. | 向0.1 mol•L-1 CH3COOH溶液从20℃升温至30℃,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$减小 |
1.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 mol NO中含有的原子数目为2NA | |
| B. | 常温下,22.4L氮气含有的原子数目为2NA | |
| C. | 1L1 mol L-1 MgS04溶液中含有的Mg2+数目为2NA | |
| D. | 2.8 g硅单质与足量氧气在高温下完全反应时,硅原子失去的电子数目为2NA |




 A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示.
A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示.