题目内容
13. 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,已知其总反应方程式为:2CH2═CH2+O22CH3CHO.则下列有关说法不正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,已知其总反应方程式为:2CH2═CH2+O22CH3CHO.则下列有关说法不正确的是( )| A. | 该装置能量转化形式试点能转化为化学能 | |
| B. | 电子移动方向:电极a磷酸溶液电极b | |
| C. | 每有0.1mol O2反应,则向负极迁移的H+的物质的量为0.2mol | |
| D. | 负极反应式:CH2=CH2-2e-+H2O═CH3CHO+2H+ |
分析 由总反应式可知CH2=CH2被氧化,应为原电池的负极反应,因电解质溶液呈酸性,则负极电极方程式为CH2=CH2-2e-+H2O=CH3CHO+2H+,正极通入氧气,发生还原反应,电极方程式为O2+4H++4e-═2H2O,以此解答该题.
解答 解:A.充电时,不能生成乙烯和氧气,不能用作充电电池,所以不能实现电能转换成化学能,故A错误;
B.电子只能经过导线,不能经过溶液,故B错误;
C.由电极方程式O2+4H++4e-═2H2O可知,每有0.1mol O2反应,则向正极迁移H+0.4mol,故C错误;
D.负极发生氧化反应,所以负极电极方程式为CH2=CH2-2e-+H2O=CH3CHO+2H+,故D正确;
故选D.
点评 本题考查了原电池原理的应用,为高频考点,注意掌握电极方程式的书写是解决本题的关键,易错点为B,注意电子不能流经溶液,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.某无色、澄清溶液中可能含有①Na+、②SO42-、③Cl-、④HCO3-、⑤CO32-、⑥H+、⑦Cu2+中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如表:
下列结论正确的是( )
| 步骤 | 操作 | 现象 |
| (1) | 用紫色石蕊试液检验 | 溶液变红 |
| (2) | 向溶液中滴加BaCl2和稀HCl | 有白色沉淀生成 |
| (3) | 将(2)中所得混合物过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀生成 |
| A. | 肯定含有的离子是②③⑥ | |
| B. | 该实验无法确定是否含有③ | |
| C. | 可能含有的离子是①③⑦ | |
| D. | 肯定没有的离子是④⑤,可能含有的离子是② |
1. 电-Fenton法是用于水体中有机污染物降解的高级氧化技术,其反应原理如图所示.其中电解产生的H2O2与Fe2+发生Fenton反应:H2O2+Fe2+═Fe3++OH-+•OH,生成的羟基自由基(•OH)能氧化降解有机污染物.下列说法中正确的是( )
电-Fenton法是用于水体中有机污染物降解的高级氧化技术,其反应原理如图所示.其中电解产生的H2O2与Fe2+发生Fenton反应:H2O2+Fe2+═Fe3++OH-+•OH,生成的羟基自由基(•OH)能氧化降解有机污染物.下列说法中正确的是( )
 电-Fenton法是用于水体中有机污染物降解的高级氧化技术,其反应原理如图所示.其中电解产生的H2O2与Fe2+发生Fenton反应:H2O2+Fe2+═Fe3++OH-+•OH,生成的羟基自由基(•OH)能氧化降解有机污染物.下列说法中正确的是( )
电-Fenton法是用于水体中有机污染物降解的高级氧化技术,其反应原理如图所示.其中电解产生的H2O2与Fe2+发生Fenton反应:H2O2+Fe2+═Fe3++OH-+•OH,生成的羟基自由基(•OH)能氧化降解有机污染物.下列说法中正确的是( )| A. | 电源的X极为正极,Y极为负极 | |
| B. | 阴极的电极反应式为Fe2+-e-═Fe3+ | |
| C. | 阳极的电极反应式为H2O-e-═H++•OH | |
| D. | 每消耗1 mol O2,整个电解池中理论上可产生2 mol•OH |
18.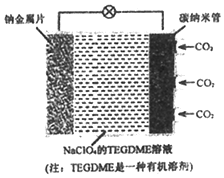 我国对‘可呼吸”的钠-二氧化碳电池的研究取得突破性进展.该电池的总反应式为:4Na+3CO2 $→_{充电}^{放电℃}$ 2Na2CO3+C,其工作原理如图所示(放电时产生Na2CO3固体储存于碳纳米管中).下列说法不正确的是( )
我国对‘可呼吸”的钠-二氧化碳电池的研究取得突破性进展.该电池的总反应式为:4Na+3CO2 $→_{充电}^{放电℃}$ 2Na2CO3+C,其工作原理如图所示(放电时产生Na2CO3固体储存于碳纳米管中).下列说法不正确的是( )
 我国对‘可呼吸”的钠-二氧化碳电池的研究取得突破性进展.该电池的总反应式为:4Na+3CO2 $→_{充电}^{放电℃}$ 2Na2CO3+C,其工作原理如图所示(放电时产生Na2CO3固体储存于碳纳米管中).下列说法不正确的是( )
我国对‘可呼吸”的钠-二氧化碳电池的研究取得突破性进展.该电池的总反应式为:4Na+3CO2 $→_{充电}^{放电℃}$ 2Na2CO3+C,其工作原理如图所示(放电时产生Na2CO3固体储存于碳纳米管中).下列说法不正确的是( )| A. | 放电时,钠金属片作负极,碳纳米管作正极 | |
| B. | 充电时,阳极反应为:2Na2CO3+C-4e-═3CO2↑+4Na+ | |
| C. | 放电时,Na+从负极区向正极区移动 | |
| D. | 该电池的电解质溶液也可使用NaClO4的水溶液 |
5.常温下,下列有关叙述正确的是( )
| A. | 在NaHA溶液中一定有:c (Na+)=c (H2A)+c (HA-)+c (A2-) | |
| B. | 能用来精确计算稀NaOH溶液中c (OH-):c (OH-)=c (NaOH)+$\frac{{K}_{W}}{c({H}^{+})}$ | |
| C. | 已知酸性:HF>CH3COOH,pH相等的NaF与CH3COOK溶液中:[c (Na+)-c (F-)]<[c (K+)-c (CH3COO-)] | |
| D. | 常温下,向5mL含有KCl和KI各为0.01mol/L的溶液中加入8mL 0.01mol/LAgNO3溶液,此时溶液中溶质的离子浓度大小关系:c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) |
2. 利用图14装置进行实验,甲、乙两池中均为1mol•L-1 CuSO4溶液,A、B均为Cu电极.实验开始先闭合K1,断开K2.一段时间后,断开K1,闭合K2,形成浓差电池,电流计指针发生偏转(Cu2+的浓度越大,其氧化性越强).下列说法错误的是( )
利用图14装置进行实验,甲、乙两池中均为1mol•L-1 CuSO4溶液,A、B均为Cu电极.实验开始先闭合K1,断开K2.一段时间后,断开K1,闭合K2,形成浓差电池,电流计指针发生偏转(Cu2+的浓度越大,其氧化性越强).下列说法错误的是( )
 利用图14装置进行实验,甲、乙两池中均为1mol•L-1 CuSO4溶液,A、B均为Cu电极.实验开始先闭合K1,断开K2.一段时间后,断开K1,闭合K2,形成浓差电池,电流计指针发生偏转(Cu2+的浓度越大,其氧化性越强).下列说法错误的是( )
利用图14装置进行实验,甲、乙两池中均为1mol•L-1 CuSO4溶液,A、B均为Cu电极.实验开始先闭合K1,断开K2.一段时间后,断开K1,闭合K2,形成浓差电池,电流计指针发生偏转(Cu2+的浓度越大,其氧化性越强).下列说法错误的是( )| A. | 闭合K1,断开K2时,电极A的质量增加 | |
| B. | 闭合K1,断开K2时,乙池溶液中c(CuSO4)逐渐增大 | |
| C. | 断开K1,闭合K2时,电极A的反应式为Cu-2e-═Cu2+ | |
| D. | 断开K1,闭合K2时,SO42-通过离子交换膜由甲池向乙池迁移 |
14.以下物质可以通过化合反应及氧化还原反应制得的是( )
①FeCl2②FeCl3③Fe(OH)2④Fe(OH)3⑤CuS ⑥Al2S3.
①FeCl2②FeCl3③Fe(OH)2④Fe(OH)3⑤CuS ⑥Al2S3.
| A. | 全部 | B. | ①②③ | C. | ①②③④ | D. | ①②④⑥ |

