题目内容
5.常温下,下列有关叙述正确的是( )| A. | 在NaHA溶液中一定有:c (Na+)=c (H2A)+c (HA-)+c (A2-) | |
| B. | 能用来精确计算稀NaOH溶液中c (OH-):c (OH-)=c (NaOH)+$\frac{{K}_{W}}{c({H}^{+})}$ | |
| C. | 已知酸性:HF>CH3COOH,pH相等的NaF与CH3COOK溶液中:[c (Na+)-c (F-)]<[c (K+)-c (CH3COO-)] | |
| D. | 常温下,向5mL含有KCl和KI各为0.01mol/L的溶液中加入8mL 0.01mol/LAgNO3溶液,此时溶液中溶质的离子浓度大小关系:c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) |
分析 A、H2A可能是强酸,就不存在H2A、HA-;
B、根据H2O?H++OH-知,NaOH溶液中,氢离子浓度仅由水电离产生,结合Kw=c(H+)×c(OH-),求解溶液的c(OH-);
C、据电荷守恒分析;
D、先根据溶解度判断沉淀的先后顺序,溶解度小的先生成沉淀,利用溶度积常数计算出各离子浓度,结合反应的程度比较溶液离子浓度的大小.
解答 解:A、若H2A可能是弱酸,NaHA溶液中存在物料守恒,c (Na+)=c (H2A)+c (HA-)+c (A2-),若H2A可能是强酸,就不存在H2A、HA-,故A错误;
B、任何溶液中都存在Kw=c(H+)×c(OH-),NaOH溶液中c (OH-)=$\frac{{K}_{W}}{c({H}^{+})}$,故B错误;
C、由于两溶液的pH相同,则两溶液中氢离子、氢氧根离子的浓度相同,根据电荷守恒可得:[c (Na+)-c (F-)]=[c (K+)-c (CH3COO-)]=[c(OH-)-c(H+)],故C错误;
D、碘化银的溶度积小于氯化银,则在5mL含有KCl和KI各为0.01mol/L的溶液中,加8mL0.01mol/L AgNO3溶液,首先生成AgI沉淀,反应后剩余的银离子的物质的量为:n(Ag+)=0.003L×0.01mol/L=3×10-5mol,继续生成AgCl沉淀,反应后剩余的氯离子的物质的量为:n(Cl-)=0.005×0.01mol/L-3×10-5mol=2×10-5mol,c(Cl-)=$\frac{2×1{0}^{-5}mol}{0.013L}$=1.53×10-3mol/L,浊液中c(Ag+)=$\frac{(1.25×1{0}^{-5})^{2}}{1.53×1{0}^{-3}}$mol/L=1.02×10-7mol/L,c(I-)=$\frac{(1.23×1{0}^{-8})^{2}}{1.02×1{0}^{-7}}$=1.46×10-9,混合溶液中n(K+)=1×10-4mol,n(NO3-)=0.008L×0.01mol/L=1×10-5mol,则c(K+)>c(NO3-),故溶液中离子浓度大小为:c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-),故D正确;
故选D.
点评 本题考查了盐类水解、强弱电解质、离子浓度大小比较等知识,题目难度中等,明确溶度积的计算原理为解答关键,试题培养了学生的分析能力及化学计算能力.

 25℃时,FeS和ZnS的饱和溶液中,金属阳离子与S2-的物质的量浓度的负对数关系如图所示.下列说法正确的是( )
25℃时,FeS和ZnS的饱和溶液中,金属阳离子与S2-的物质的量浓度的负对数关系如图所示.下列说法正确的是( )| A. | 溶解度S(FeS)<S(ZnS) | |
| B. | a点表示FeS的不饱和溶液,且c(Fe2+)>c(S2-) | |
| C. | 向b点对应溶液中加入Na2S溶液,可转化为c点对应的溶液 | |
| D. | 向c点对应的溶液中加入Na2S溶液,ZnS的KSP增大 |
| A. | 0.1mol•L-1NaHC2O4溶液(pH=5.5):c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) | |
| B. | 0.1mol•L-1NaHS溶液:c(OH-)+c(S2-)=c(H+)+c(H2S) | |
| C. | 0.1mol•L-1CH3COOH溶液和0.1mol•L-1CH3COONa溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,已知其总反应方程式为:2CH2═CH2+O22CH3CHO.则下列有关说法不正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,已知其总反应方程式为:2CH2═CH2+O22CH3CHO.则下列有关说法不正确的是( )| A. | 该装置能量转化形式试点能转化为化学能 | |
| B. | 电子移动方向:电极a磷酸溶液电极b | |
| C. | 每有0.1mol O2反应,则向负极迁移的H+的物质的量为0.2mol | |
| D. | 负极反应式:CH2=CH2-2e-+H2O═CH3CHO+2H+ |
| A. | 在实验室中,从海带中提取单质碘的方法:取样→灼烧→溶解→过滤→萃取 | |
| B. | 用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度 | |
| C. | 向FeBr2溶液中加入少量氯水,再加CCl4萃取,CCl4层无色,水层变为棕黄色,说明Fe2+的还原性强于Br- | |
| D. | 室温下,向苯和苯酚的混合溶液中加入浓溴水,充分反应后过滤,以除去苯中少量的苯酚 |
| A. | 用葡萄糖制镜或保温瓶胆 | B. | 用Na2S除去废水中的Hg2+ | ||
| C. | Na2O2作供氧剂 | D. | SO2漂白织物 |
| A. | A不可能为碳单质 | |
| B. | 若A为金属单质,则 A-定位于第三周期第IA族 | |
| C. | 若常温下D的浓溶液能使铁、铝钝化,则A可能是单质,也可能是化合物 | |
| D. | 若A是共价化合物,A的水溶液一定显碱性 |
 设计如图所示实验装置,夹子在实验开始时处于关闭状态,将液体A滴入烧瓶与气体B充分反应;当打开夹子后发现试管内的水立刻沸腾.则液体A和气体B的组合不可能是( )
设计如图所示实验装置,夹子在实验开始时处于关闭状态,将液体A滴入烧瓶与气体B充分反应;当打开夹子后发现试管内的水立刻沸腾.则液体A和气体B的组合不可能是( )| A. | 水、氯化氢 | B. | 稀硫酸、氨气 | ||
| C. | 氢氧化钠溶液、SO2 | D. | 氢氧化钠溶液、CO |
| A. |  检验K+的存在 检验K+的存在 | B. | 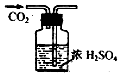 干燥CO2 | C. |  分离酒精与水 分离酒精与水 | D. |  蒸发食盐水 |